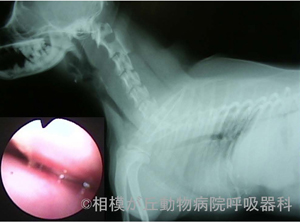
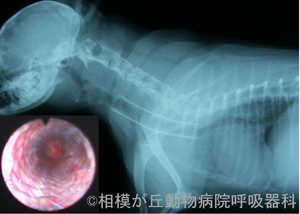
※本文中の上付き数字は、引用文献をご参照ください。
気管支鏡検査とは?
細く柔らかい内視鏡を口から入れて、喉頭、気管、気管支、肺の病気を詳しく調べる検査です。動物の場合、全身麻酔が必要です。X線検査やCT検査にて気道や肺に異常な影が認められた場合、その原因を調べ確定診断します。また気管支鏡を用いて異物除去や腫瘍切除などの気道内治療も行うことができます。気道内治療は、開胸手術や気管外科に比べとても侵襲が少ないためきわめて迅速に回復しますが、手技には特殊な設備が必要であり、何より十分な熟練を要します。
獣医療では気道内治療は未だ挑戦的領域であり、実施している施設はほとんどありません。ここでは飼い主の方への情報提供はもちろんですが、獣医師の皆様にも気管支鏡を正しく適用していただけることを願って、当院実施法を参考に詳しく記述いたしました。
- 検査の適応(呼吸器内視鏡ガイドライン1より一部改変)
- 肺拡張不全、不整脈、出血、気胸が検査中生じることがあります。しかし、検査前に一般状態や呼吸器系の評価を十分に行い、さらに一定量の呼吸器に関する知識があり、気管支鏡検査に関する通常の経験や技術をもって行えば避けられます。猫では嘔吐が検査後に生じることがありますが一過性です。
- 検査適応例
-
- X線検査または胸部CT検査での肺野異常陰影がある
- 2ヶ月以上続く慢性発咳
- 強い咳が続き、2週間治療をしても止まらない
- 喀血・血痰
- 喘鳴などの呼吸異常
- 気道内に異物や塊病変が疑われる
以下全てが当てはまる場合、検査の適応にはなりません。
- 急に始まった強い持続性の咳
- 経過は1週間以内
- 問診およびX線検査にて気道異物を認めない
→急性気管・気管支炎の可能性があり、抗菌剤療法を2週間継続してください。
それで90%以上の咳は治ります。それでも咳が消失しなかったら検査の適応になります(上記③)。 - 意義
- 難治性咳や肺野異常陰影の原因は、気道の変形や異常な動き、感染、炎症、アレルギー、異物、免疫介在性、腫瘍性など様々です。病変が、気管支鏡が通る大きい気道内にあれば、どこに、どのようにあるのかを直接目で見ることができ(図01①)、組織を採ったり(図01②)、ブラシで擦過して病原体や細胞を採ったりして(図01③)、原因を調べることができます。
- 気管支鏡が通らない末梢気道から肺に病変があれば、X線透視下でその部分まで生検鉗子を進め組織を採ったり(図01④)、気管支肺胞洗浄(図01⑦)を行って細胞成分や病原体を洗い出してそれを顕微鏡で観察しどのような病気が起きているか知ることができます。リンパ節が大きく腫れていれば針吸引で細胞をとり(図01⑥)原因を調べることができます。
- また、呼吸の動きをみながら観察できるので、喉頭や気管・気管支の動きの異常についても評価できます。また、異物があればそのまま摘出できるかもしれません。これらは、静止画観察のみのX線検査やCT検査では実施不能です。つまり、気管支鏡検査は、気道や肺内で「何が起きているのか」をX線やCT検査からさらに一歩進んで、確定診断できる検査ということになります。確定診断できれば、治療法が正確に決定されます。
- たとえば、細菌感染なら細菌の種類と有効な抗生剤が決まり、確実に治療されます。細菌感染なくアレルギーだけなら抗生剤を必要とせず抗アレルギー治療のみを行えば病気が治ります。腫瘍かと思ったら、異物だったり、炎症性結節病変だったり、真菌感染だったり、寄生虫結節だったりすることがあります。異物なら摘出できればそれで治療終了ですし、炎症性結節病変なら抗がん剤ではなく抗炎症剤で治療し、真菌感染なら抗真菌剤で洗浄したり、寄生虫結節なら駆虫薬投与と様子観察でもよいかもしれません。
- 原因を推定して、あれこれ不要の治療薬を使用していると、余計な病気を作ってしまい、かえって病気が複雑化してしまうかもしれません。もしかしたら癌でないのに抗がん剤や放射線治療が始まってしまうかもしれません。だから、治療前に確定診断が重要なのです。
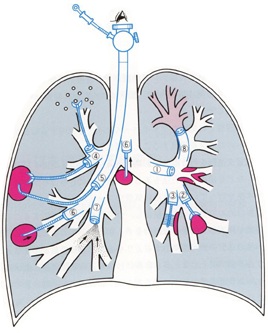
図01|気管支鏡検査。観察だけではなく、生検や気管支肺胞洗浄など気道や肺全体の検査を実施できる(於保健吉、雨宮隆太. 気管支ファイバースコピー その手技と所見の解析・気管支ビデオスコピーとその解説 第6版. 東京: 医学書院, 1998-p204, 図Ⅳ-1より転載)
- 合併症
- 肺拡張不全、不整脈、出血、気胸が検査中生じることがあります。しかし、検査前に一般状態や呼吸器系の評価を十分に行い、さらに一定量の呼吸器に関する知識があり、気管支鏡検査に関する通常の経験や技術をもって行えば避けられます。猫では嘔吐が検査後に生じることがありますが一過性です。
- 検査できない例
- いくら有用な検査とはいっても合併症を起こしやすい動物や検査に耐えられない動物に無理に実施できません。気管支鏡検査は実施の見極めの判断がとても重要となります。以下がその判断基準となります(呼吸器内視鏡ガイドライン1改変)。
- 絶対禁忌(行ってはいけません)
-
- 重度の呼吸困難
- 全身麻酔を実施できない程度の全身状態が悪化しているとき
- 重度の心肥大
- 相対禁忌(基本的には危険ですが、経験や装置や検査内容によっては実施可能)
-
- 検査前覚醒時の動脈血酸素分圧60mmHg未満
- 気管気管支軟化症
- 体重2.5kg未満
- 血液凝固能低下
- 経験不足(10例以下。ヒトでは50例以下と言われる)
現在、当院呼吸器科では、一次検査にて肺疾患による重度呼吸困難と診断されたり、動脈血酸素分圧60mmHg未満であったりした場合には、気管支鏡検査を実施せず、状況に応じてまず呼吸症状の初期安定化に徹します。
当院における気管支鏡検査の方法
当院では2003年から犬猫の気管支鏡検査に取り組んでおり、安全性と有益性と確実性を最も考慮した結果、人医や小児医学で一部取り入れられている方法を導入しました。その後約10年間同じ方法を継続し、数多くの実施経験から、特に超大型犬の少ない日本の獣医療においては、この方法がもっとも優れていると確信しております。
1)使用する気管支鏡
当院では、体重1kg未満の犬から体重60kgの大型犬まで実施可能で、以下の軟性スコープと硬性気管支鏡を動物の種類、体格、検査や処置内容に応じて使い分けております。

図02|OLYMPUS BF-P290。先端部外径4.2mmの気管支ビデオスコープ(画像提供:株式会社AVS)。現在、呼吸器科でもっとも頻用する気管支鏡。チャネル径2.0mmなので多様な処置具用いることができる。
- 先端部外径3.1mm、有効長600mm、チャネル径1.2mmのヒト用の軟性気管支ビデオスコープ
(OLYMPUS BF-XP290, オリンパス)
: 体重3.5kg未満の犬、体重4.5kg未満の猫 - 同4.2mm、有効長600mm、チャネル径2.0mmのヒト用の軟性気管支ビデオスコープ
(図02。OLYMPUS BF-P290, オリンパス)
:体重3.5~14kgの犬、体重4.5kg以上の猫 - 同5.4mm、有効長1100mm、チャネル径2.2mmのヒト用の上部消化器汎用軟性ビデオスコープ
(OLYMPUS GIF-1200N, オリンパス)
:体重14~60kgの犬 - 先端外径7mm×5mm、有効長250mm、鉗子孔内径3.8mmの動物・異物用挿管用硬性気管支ファイバースコープ(図03。MVE-VB250, 町田製作所)
:体重3.0〜6.0kgの犬・猫

2)ラリンゲルマスクの使用
当院ではより安全に気管支鏡検査を実施するためにラリンゲルマスクを検査中の気道確保に用いております(図04)。ヒト小児の気道異物除去時の気道確保にもラリンゲルマスクが使用され気管支鏡操作への安全性が報告されています2。
気管の中にチューブを入れる訳ではないので猫程度の小さい動物に適用する最も小さいラリンゲルマスクでもチューブ内径が5.25mmもあるので外径3.6mmの気管支鏡を通して十分な隙間があり、自発呼吸を阻害しません。さらにY型アダプターを接続すると、検査中常時酸素を投与しながら、安全に気管支鏡検査や気管支鏡手術を実施することができます。
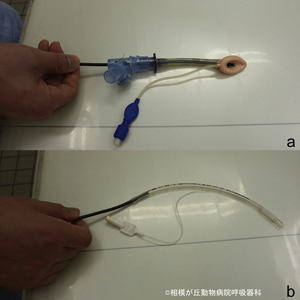
図04|ラリンゲルマスク#1と気管チューブID4.5mm。最も小さいラリンゲルマスクでもチューブ内径が5.25mmもあるので外径3.6mmの気管支鏡を通して十分な隙間があり、自発呼吸を阻害しません。 一方、猫などに使用する気管チューブでは外径3.6mmの気管支鏡はアダプターを外しても通過できない。ラリンゲルマスクにY型アダプターを装着すると側管から麻酔回路を介し酸素や麻酔ガスを投与することができる。
3)X線透視装置のガイド
気管支鏡検査中、スコープの位置を正確に把握できます。また、末梢気道へブラシや生検鉗子を進めるときには意図する方法や部位に到達するように、または、胸膜を穿通しないようにするために必ず必要となります。検査の確実性と安全性を高めることができます。検査中は内視鏡モニタと透視モニタを並べて内部の様子と同時にみえるようにしております(図05)「気管支ビデオスコープと透視装置モニタ」の画像を追加しております。
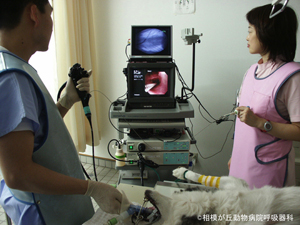
図05|X線透視ガイド。末梢気道へブラシや生検鉗子を進めるときには意図する方法や部位に到達するように、または、胸膜を穿通しないにするために必ず必要となる。図はLB1V1に鉗子を誘導しているところ。
最先端の人の呼吸器医療でも使用されている気管支ビデオスコープシステム(OLYMPUS EVIS LUCERA ELITE)を2018年4月に導入しました。当院呼吸器科では、X線透視と気管支鏡検査を連動して行いますので、細かい気管支・肺内の検査や、気道内の内視鏡手術を口から入れる内視鏡にて安全かつ正確に行います。鮮明な静止画や動画は診療内容説明や学術研究のために全て記録しております。
4)仰臥位
体位は仰臥で行っております(図06)。これは、i) ラリンゲルマスクのチューブ口部分が上向きになり気管支鏡が挿入しやすい、ⅱ)気管支系が全て上向きになり気管支鏡操作しやすい(アンギュレーションレバーを操作しやすいUP方向主体で使用できる)、ⅲ)気管支肺胞洗浄を行う際に注入後重力方向に流れ出るので強い陰圧をかけなくても注入液をよく回収できる、すなわち気管支肺胞洗浄をより安全に行うことができる、ということによります。
アメリカでは動物を伏臥にして気管支鏡検査を行っております。おそらく超大型犬では仰臥位にすることが困難だからだと思います。気管支軟骨がしっかりしている大型〜超大型犬ではiii)の要素は無視できる範囲になると思います。人医では仰臥位にて気管支鏡検査を行っております。自然な臥位ですし、2)と3)の理由によります。
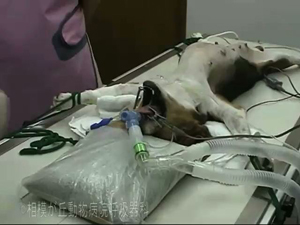
図06|仰臥保定。気管支鏡検査を行いやすくするためこのような保定で行っている。
5)プロポフォール静脈内持続投与にて維持麻酔
気管支鏡検査中、麻酔回路は開放になり、自発呼吸下で行わなければいけません。吸入麻酔はリークしてしまい、予定通り管理できませんし余分に多く吸入麻酔薬を流すと手術室が吸入麻酔薬で汚染してしまいます。麻酔管理を意図通りに行うにはプロポフォールを静脈内持続投与(CRI)がもっとも良い方法です。流速は状況に応じ0.1〜0.4mg/kg/minにしております。
6)気管支鏡挿入開始の目安は自発呼吸で1分間に呼吸数30回以下
呼吸が速いことは十分な麻酔深度にいたっていない証拠であり、そのときに気管支鏡を挿入しても喉頭反射があったり、咳刺激を起こしたりしてしまい、観察はできません。
7)系統的な観察-同じ順で同じ場所をみて写真撮影する
毎回、気管気管支樹内の同じ部分を同じ順でみます。系統的に検察することによって異常所見を迅速に見つけ整理できます。観察順は図07の通りです。
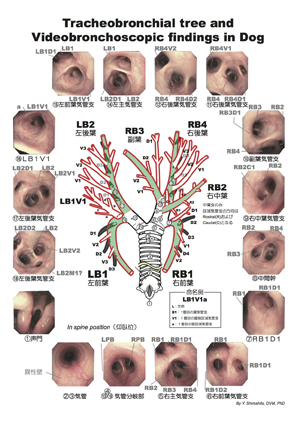
図07|系統的観察。犬の気管支分岐命名法に従い、図の順で系統的に気管気管支樹内を観察する。
8)検査順は、肉眼観察→気管支ブラッシング→生検(肺生検)→気管支肺胞洗浄、を遵守する。
チャンネルに液体が入る気管支肺胞洗浄は最後にします。処置具をいれる処置をその後に行うとスコープの対物レンズが液体に触れ視野が確保できなくなります。
9)気管支鏡検査終了後は速やかに気管チューブを挿管し、PEEP下陽圧換気を行い、検査前の呼吸状態に応じ30分-1時間位かけてweaningを行う。
気管支鏡検査はFIo2 60%で開始し、処置内容に応じて80%まで一時的に上げることがあります。閉塞性肺疾患ではFIo2を30-40%で維持することもあります。WeaningはSpo2 95%以上を維持するようにFIo2を22-25%まで次第に落としていき、その後、人工呼吸の呼吸数を下げ自発呼吸を交えていきます。Spo2が下がらなければ自発呼吸のみでPEEPを0cmH2Oにし、自発呼吸が安定し覚醒したところで抜管します。
10)検査後、検査前Pao2の値に応じ酸素室管理で6-24時間様子をみます。
実施される検査内容
① 肉眼観察
気管支鏡的分岐命名法に3,4従い系統的に観察します(図07)。方向、位置、気管支および分岐角度をただちに識別できるようにします。検査では、以下の所見を観察します1。
- 粘膜の変化:発赤、充血、浮腫、上皮下血管走行の消失、光沢の消失、凹凸不整、壊死、軟骨輪の不明瞭化、上皮下弾性線維走行の消失、隆起病変、易出血性、出血、炭粉沈着、肉芽形成
- 壁構造の変化:虚脱、動的虚脱、膜性壁の伸張、気管支拡張、分岐異常、憩室、嚢胞形成
- 管内要因による変化:多量の粘稠分泌物、血液貯留、粘液栓、異物
- 管外要因による変化:分岐鈍化、圧迫性狭窄/閉塞、実質内腫瘍による圧排
図08は犬の好酸球性気管支肺症の粘膜の変化(多発性粟粒性隆起病変)を示しました。粘膜を不必要に擦ると咳が生じたり粘膜が発赤したりするので、常に管腔の中央にスコープ先端が位置するよう慎重に操作します。画面左右は手首のrotation, 画面上下はアングレーションレバーのUPとDOWNで操作します1。
CTデータから構成されるvirtual bronchoscopyとの大きな違いは、粘膜の色や表在血管、血管や心拍動に応じた気管支壁の動きや連続した呼吸相間の気管支径の変化などのダイナミックな観察ができ、生命感を忠実に実感できるということはいうまでもありません。
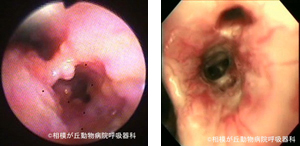
図08|肉眼観察。左は、慢性発咳を示したマルチーズの右主気管支の粘膜病変。多発性粟粒性隆起病変 を示し生検にて好酸球性気管支肺症と診断された。右は、急性呼吸困難を示した雑種犬のLB2V2の粘膜病変。凹凸不整と充血を示している。急性好酸球性肺炎と診断された。
② 気管支ブラッシング
粘膜主体型病変の細胞診と微生物検査を行います。管腔に平行に擦過できるので直視下ではどこでも適応できます(図09)。contamination防止のためのシースがついているものがあります。目的とした局所の細胞を確実に採取するにはシース付を選びます。しかし、RB1やLB1のようにスコープを強く屈曲しないと挿入できない気管支内の採取にはシースがあるとアンギュレーションがかけられなくなります。
末梢組織の擦過には透視下ガイド下となるが、シースを末梢にいれてからブラシを出すと肺胸膜を穿通するおそれがあります。ブラシ先端は透視下で慎重に位置を確認しながらゆっくり行います。通常ディスポーザブルです。
細胞診の評価項目は鏡検にて以下の出現頻度で表現します。上皮細胞塊(0〜3+);独立した上皮細胞(0〜3+)、好中球(0〜+3)、好酸球(0〜+3)、リンパ球(0〜+3)、マクロファージ(0〜+3)、異型細胞/腫瘍細胞(0〜+3)、細胞内・外細菌(0〜+3)。正常は、上皮細胞のみ認められ炎症細胞はわずかです。
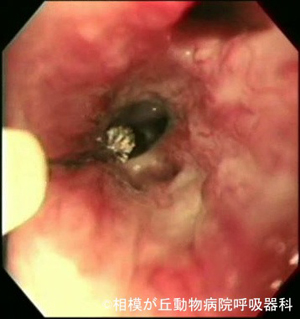
図09|気管支ブラッシング。粘膜病変に対して細胞診ブラシを用いて行う。
③ 直視下生検
先端がカップ型になって組織を挟みとるような構造の生検鉗子を用いて気道粘膜上に生じた隆起病変や気管支分岐部の粘膜病変の組織を採取します(図10)。直視下で粘膜や隆起病変を採取するときは、動脈瘤との鑑別が重要です。動脈瘤を生検すると大出血を引き起こしてしまいます。
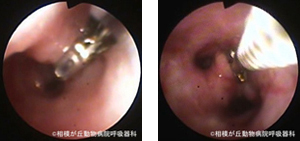
図10|直視下粘膜生検。左は呼吸困難を示した猫の気管内の多発結節状病変。生検にて気管腺癌と診断された。右は1ヶ月間強い咳が続くシーズーの気管分岐部所見。気管分岐部に多発結節病変がみられた。生検の結果、肉芽種様炎症と診断された。
④ 透視下経気管支生検(Transbronchial biopsy: TBB)
肺野結節陰影に対し透視下に生検鉗子を誘導して行います。著者は、胸部X線上の気管支走行分布5(図11)に基づいて目的気管支をあらかじめ決定しています。スコープを目的気管支入口部まで誘導し、そこに鉗子を挿入し透視下で慎重に肺内ですすめます(図12)。
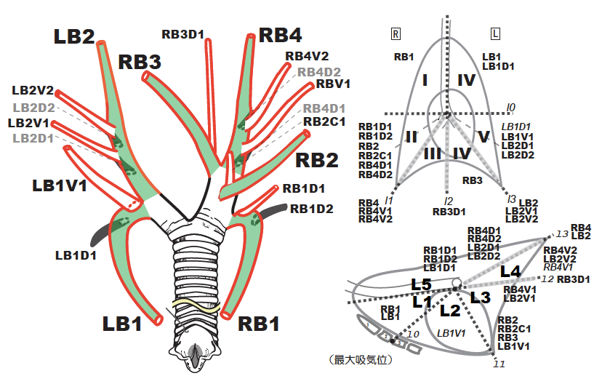
図11|単純胸部X線上の気管支走行分布。左は気管支鏡にて同定可能な20本の葉および区域気管支20本。右はそれら気管支が単純胸部X線写真での走行分布を示した。胸部X線写真で限局性病変がある場合、関与する気管支を推定できる。
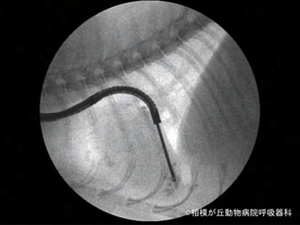
図12|透視下肺生検(TBB) 胸部X線写真にて右中肺野腹側に直径2cmの結節陰影が認められた猫に対する肺生検の様子。単純胸部X線写真およびCT検査にてRB2が関与気管支と判明し生検鉗子を誘導しヒットした。腫瘍や感染は否定され、細胞成分の少ない非特異性炎症であることが分かった。
⑤ 透視下経気管支肺生検 (Transbronchial lung biopsy:TBLB)
びまん性間質陰影や限局性肺野浸潤陰影に対し透視下で行います6(図13)。できるだけ肺末梢部で生検すれば出血が少ないですが、犬猫の肺臓側胸膜は薄く、鉗子で穿通しやすいので注意が必要です。犬猫におけるTBLBの手技や合併症に関する詳細な記述はなく、現在検討中の課題といえます。著者の経験では、小型犬や猫の同一気管支から複数標本を採取することは困難に思います。
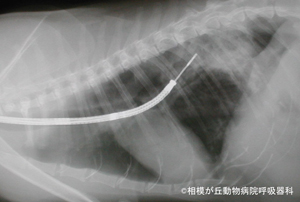
図13|透視下経気管支肺生検(TBLB) 胸部X線写真にて限局性浸潤影を示した慢性呼吸不全を示す猫に対して行ったTBLB。腫瘍や感染が否定され、粘液の蓄積であることが分かった。
⑥ 気管支肺胞洗浄(Bronchoalveolar lavage: BAL)
末梢気道および肺胞領域の評価法であり、気管支鏡検査の中で行われます7。画像上の肺疾患を炎症性/感染性/腫瘍性疾患への病態鑑別、ひいては確定診断に導くものです。特定の気管支にスコープを挿入しそこから滅菌生理食塩液を末梢実質組織に十分量注入し、ただちにそれを回収します(図1)。その回収液中の細胞成分および病原体を調べます。BALは肺生検より簡便・安全・経済的なので、獣医呼吸器診療では導入しやすい主要な診断手技のひとつとなっています8。
- 診断意義:肺胞出血、肺胞蛋白症、腫瘍、病原体検出、好酸球性肺疾患を確定診断できます。多くの肺疾患では様々な炎症パターンの種類と程度を把握でき、他の臨床所見とあわせて確定診断のために有用な所見が得られます。
- 適応:末梢気道・肺胞・間質性肺疾患の患者8、とくにびまん性肺疾患9がよい適応となります。
- 禁忌:重度の呼吸困難8、全身状態不良や心不全患者など全身麻酔リスクが高い患者
- 相対禁忌:誤嚥性肺炎、重症肺水腫、重度の下気道感染症
- 合併症:一過性低酸素血症8,9、肺拡張不全10、ごくまれに気管支痙攣縮、気胸、発熱9。患者選択を誤らず手技に習熟すれば合併症が起こることはありません8。一般に検査後24時間まで肺音にクラックルが聴取されますが、48時間後にはX線所見も消失します8。
- 手技
- 洗浄液の採取:目的気管支にしっかりスコープを楔入後、滅菌生食水10ml×3回(外径4.0mm以下の気管支軟性スコープ使用時)または25ml×3回(外径4.8mm以上のスコープ使用時)を注入し回収します(図14)。
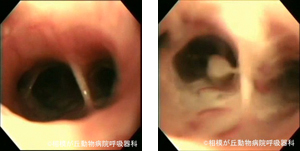
図14|気管支肺胞洗浄 注入(左)と回収(右)。注入時に気管支が拡張し、回収時に粘液が吸引されていることが分かる。
びまん性肺疾患の場合、犬ではRB2、猫ではRB3に挿入することが多いです。分注する洗浄液は3本あらかじめ用意しておきます。著者はBAL用吸引キット(気管支肺胞洗浄用吸引キット、住友ベークライト)を用いています。術者は右手でスコープを目的気管支まで進め、軽く吸引しすぐに気管支が虚脱する部分で固定します。助手に洗浄液をチャネルから勢いよく注入してもらい、術者はモニタをみながら常に気管支の中央にスコープの先端があるように吸引ボタンを押し洗浄液を回収します。
再び気管支の虚脱が確認できたら一度吸引を止め、再度吸引を行います。これを3回程度繰り返します。ボトルに洗浄液が戻らなくなったところで、次の注入を行います。回収率は40%以上を目標とします。25%以下では回収液の信頼度は低いと言われております9。挿入気管支、注入量、回収率を必ずデータに付記するようにします。検査中は呼吸の様子、心電図、Spo2を観察します。気道過敏が疑われる場合、検査前に気管支拡張剤を投与しておきます8。
- 回収洗浄液の処理:回収液はプラスチック容器に集め1時間以内に解析を行います8。
- 適応:末梢気道・肺胞・間質性肺疾患の患者8、とくにびまん性肺疾患9がよい適応となります。
- 総細胞数算定:洗浄原液を使用し血球計算盤で算定します8,9。1ml3当たりの細胞数で表現します。
- 細胞標本作製:主に細胞遠心法と細胞沈降法9があります。著者は特別な装置を必要としない後者で行っています。スライドグラスに直径1cmの孔を開けたろ紙(東洋ろ紙2号)を、3mlのディスポシリンジの外筒先端側を上にして両面テープを介してはさみ、沈降用の器具をつくり、BAL原液0.5mlを15分静置後、Diff-Quickで染色します。余分な水分はろ紙に吸収されます。あと2標本作製しGram染色と未染色標本とします。残った洗浄原液を細菌培養に供します。
- <回収洗浄液の評価>
性状:肉眼所見です。正常は半透明で液面には泡の層がみられます。泡はサーファクタントのためです。評価項目は、粘液の混入/沈殿(0〜3+)、にごり(0〜+3)、色:白濁、透明、血性(赤色) - 総細胞数と細胞診(表1):腫瘍細胞や病原体の観察とともに、細胞分画を観察します。泡沫状マクロファージの数と形態(巨大化、空包形成、貪食像、細胞質の好塩基性低下)の程度は気道の慢性刺激を反映します8。細胞分画以外の評価項目は、泡沫状マクロファージの量と状態;なし:0、中型泡沫マクロファージが大多数(80%以上):+1、中型と大型泡沫状マクロファージが同等に混在:+2、大型〜巨大泡沫マクロファージが大多数(80%以上):+3、ヘモジデリン貪食マクロファージの数(0〜3+)、異型細胞・腫瘍細胞の数(0〜+3)。
Hawkinsは出現細胞の種類と比率から、細胞診所見を以下のように⑴から⑹まで分類することを提唱しております 7。私はそれに加え、(7)リンパ球増加型を加えております。
- 急性好中球性炎症:好中球が圧倒的多数。変性好中球、微生物を貪食したものなどあり7。主に細菌感染を示唆7。当院呼吸器科診断基準:経過が2週間以内。好中球が圧倒的多数(>90%)。とくに変性好中球が多い。
- 慢性活動性炎症:好中球とマクロファージが増加。細胞屑の貪食像あり7。感染、腫瘍、非感染性炎症などさまざま7。細菌感染の回復期を含む7。当院呼吸器科診断基準:経過は2週間以上。好酸球やリンパ球など正常値に対する著明な相対的増加がなく、好中球が増加(5〜90%未満)。細胞数も増加していることが多い。
- 慢性炎症:泡沫状マクロファージ主体で、総細胞数も増加している7。わずかだが好中球、泡沫状マクロファージ、形質細胞の増加もある7。感染や腫瘍のときの非特異的所見である7。当院呼吸器科診断基準:マクロファージ主体の細胞数の増加。細胞数が増加していなくても、泡沫状マクロファージが主体(2+以上)の場合も含む。
- 好酸球性炎症:好酸球の増加7。過敏性反応に関係し、寄生虫性、好酸球性気管支肺症でみられる7。当院呼吸器科診断基準:好中球やリンパ球より好酸球が相対的に増加。犬ではBALF中好酸球比率が3%以上、猫では17%以上。
- 出血:赤血球の増加7。赤血球の貪食像やヘモジデリン貪食細胞あり7。慢性炎症には出血が生じる7。当院呼吸器科診断基準:炎症細胞出現とは別に評価。背景に赤血球が増加し、かつヘモジデリン貪食細胞も毎視野に数個以上確実に認められる。
- 腫瘍:悪性所見の基準をいくつか満たす細胞群がみられる7。肥満細胞、リンパ芽球などがよくみられる7。重度な炎症性変化には上皮の過形成もみられるが腫瘍性との鑑別は困難である7。当院呼吸器科診断基準:炎症細胞出現とは別に評価。異型細胞塊やリンパ芽球が認められる。急性間質性肺炎時の剥離上皮細胞は鑑別される。
- リンパ球増加型:リンパ球が正常より著明に増加。当院呼吸器科診断基準:好中球や好酸球よりリンパ球が際立って増加する。リンパ球比率が30%以上。典型例はBAL液中リンパ球比率は>50%を示す。小リンパ球中心であれば、過敏性肺炎と診断する。
- 病原微生物検査:定量培養または細胞内細菌数によって有意な起炎菌かどうか判断します(表2)。
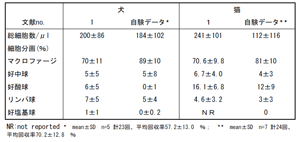
表1|気管支肺胞洗浄液(BALF)細胞診の正常所見。猫では好酸球数が多い(日本小動物内視鏡推進連絡会呼吸器内視鏡分科会. 呼吸器内視鏡ガイドライン p27 表3より転載)。文献1:Hawkins EC. Bronchoalveolar Lavage In: King LG, ed. Textbook of Respiratory Diseases in Dogs and Cats. St.Louis: Saunders, 2004;118-128.

表2|BALFの微生物検査の評価。細胞診にて全細胞数の1%以上に扁平上皮が含まれていると口腔内菌の汚染が示唆されるので、それ以下なら気道内微生物検査結果は気道内の微生物を反映する。定量培養およびグラム染色での所見を満たせば、有意な気道内起炎菌と判断する(日本小動物内視鏡推進連絡会呼吸器内視鏡分科会. 呼吸器内視鏡ガイドライン p27 表4より転載)
⑦ 経気管支吸引細胞診 (Transbronchial aspiration cytology: TBAC)
外筒・内筒構造よりなり内筒先端に注射針があり、手元で吸引をしたり注入したりするためにシリンジが接続できる構造となっている吸引生検針を用い、通常、透視下に気管分岐部の肺門リンパ節に対して気管壁を介して穿刺吸引を行います(図15)。
先端の穿刺針は必ず内視鏡視野内でガイドから出し入れします。チャネル内で針を出すとチャネルを損傷してしまいます。採取した検体からFNAの要領で塗抹標本を作成し細胞診標本とします。
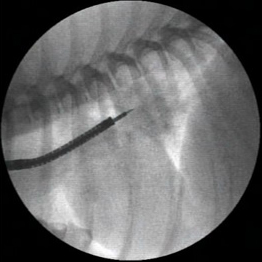
図15|経気管支針穿刺吸引(TBAC)。慢性発咳と肺門部リンパ節腫脹を示すミニチュアダックスに対しTBACを行った。細胞診の結果、リンパ増殖性疾患が疑われた。
気管支鏡下気道内治療
以下のような気道内処置を行うことができます。
① 気道異物回収
気管支鏡のもっとも有用な処置といえます。気管内異物回収は出血や穿孔など合併症が生じることがあり、気管支鏡操作の十分な熟練は必要条件であり、適切な処置具を取りそろえ、緊急外科にも備えてから開始する必要があります。気管内異物は急性呼吸困難症状や胸部X線検査から疑うことは可能です。一方で気管腫瘍との鑑別も要求されます。したがって、異物や腫瘍のどちらでも診断と処置を同時に迅速かつ低侵襲に実施可能な気管支鏡の有用性は高いと思われます。
また、気管支内異物の場合、限局性胸部X線異常陰影による診断陽性率は約70%に過ぎず11、逆に胸部異常影を示さない症例もあります11。やはり、確定診断と処置を兼ねることができる気管支鏡の有用性は高いと言えます。ヒト小児では、呼気時肺過膨張が中枢気道異物で高率にみられ12、筆者も同様の症例を経験しています。適切な処置法は異物の位置、形状、性状によります。気管内異物は猫で、小石13-16、小枝11,16、植物片11,17、樹皮16が報告されています。気管分岐部以降では犬、特に狩猟犬で、草ノギや茎状物が多く報告されています16。合併症は、気道内出血、縦隔気腫や気胸11です。 私も猫では小石状異物(図16)や魚骨、犬では食塊を気管支鏡下に速やかに診断し、ただちに摘出できた症例を経験しました18。
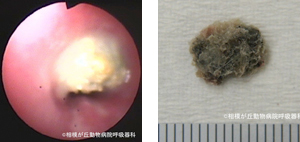
図16|気道異物回収。3週間前から急に元気消失、体重減少した猫の気管内に観察された異物。園芸用のオアシスの一部と思われた。内視鏡下にキュレットを用いて比較的容易に回収できた。
気道異物回収には以下の3段階を確実に行います。
- 観察 気管内異物の場合、気管チューブを挿管せずに初めからラリンゲルマスクで気道確保し気管支鏡で慎重に気管内を観察します。極細径気管支鏡で異物を超えた気管支樹内にも異物がないか観察しておきます。腫瘍なら灰白色から赤色で表在血管を伴うことが多いです。異物は周囲粘膜色と明らかに異なる。有棘性の気管内異物回収後に突然気胸が生じた例もあり17、異物の形状観察は十分行い、気胸発症にも備えておきます。異物周囲に肉芽形成が著しい場合、処置を中止しステロイド投与を一定期間行ったのちに処置を再び試みたほうがよいです12。
- 剥離・移動 気管粘膜との連続性やその塊状物の可動性を、生検鉗子または細胞診ブラシなどを用いて出血を起こさないように辺縁から慎重に剥離してみます。針状部位に気をつけます。出血が視野を妨げれば、その都度吸引チューブで吸引してから再開します。剥離できたら、把持鉗子、バルーンカテーテル、キュレットを用いて異物を口側に移動してみます。麺類など柔軟な食塊などは、スコープ先端にチューブ断端を接続し吸引する方法19や硬性気管支鏡の吸引管使用がよいと思います。
- 把持・回収 通常の把持鉗子が使用できればよいですが、異物は声門のところで滑脱しやすいです。そのときは気管チューブのカフを膨らませながら把持した異物と同時に引き出してみます。硬く大きな球状物であればバスケット鉗子で把持します。ただ狭い気道内でバスケットが十分開かないことがあります。軟性気管支鏡処置具で把持・回収が困難なら、硬性気管支鏡でやりなおすと確実です。犬猫の気道異物の79%は軟性気管支鏡のみで回収できたとの報告がありますが11、この報告では比較的把持・回収が容易な草ノギなどの気管支内異物がほとんどを占め、大きな硬い異物は含まれていませんでした。
- 最終確認 異物回収後は、気道内に異物遺残がないか、軟性気管支鏡を用いて確認して終えます。
② サクションカテーテル吸引
気道内処置中の出血、把持鉗子やバスケット鉗子では崩れやすい塊状物(図17)、柔軟な気道内腫瘍はチャネル内にサクション用カテーテルを挿入し、内視鏡視野範囲内で吸引除去します。塊状物の場合、キュレットや把持鉗子などで広い気管支内にかき出してから吸引します。細い気管支内で吸引しても気管支自体が虚脱して塊状物を吸引できなくなりますし、最悪その吸引処置により無気肺を形成してしまうかもしれません。気道内や気道ステント内に滞留した粘稠な分泌物の吸引時にも使用します。その場合、処置前にサクション用カテーテルに温生食水を吸引しておくとカテーテル内が粘液で閉塞しにくくなります。
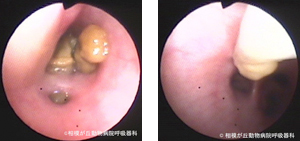
図17|サクションカテーテル吸引。右中肺野に結節陰影を示したシーズーに右中葉気管支内に塊状物が認められた。鉗子で把持すると簡単に崩れるのでサクションカテーテルを用いて少しずつ吸引除去した。病理組織検査の結果、壊死した炎症細胞塊であった。
③ ホットバイオプシー
形状は生検鉗子と同じだが先端のカップで把持したときに高周波を通電し、凝固止血しながら腫瘤病変を切除していきます(図18)。処置具はチャネル径2.0mm用のものからあります。先端を組織に接触させ20-40Wの出力で単に焼灼凝固させることも可能です20。易出血性腫瘤病変の処置に有用です。
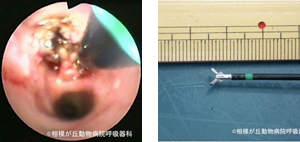
図18|ホットバイオプシー。左主気管支直前に生じたポリープ状病変に対し、止血と凝固を兼ねながらホットバイオプシー鉗子にて少しずつ摘出した。
④ アルゴンプラズマ凝固
気道内肉芽や気道内腫瘍の失活や縮小に気管支鏡下処置として近年医学領域で使用されるようになってきました21。主な作用は非接触凝固です。凝固深度は最大3mm程度と浅く制限されています。レーザー治療の強力な蒸散作用に比べ組織縮小効果は小さいですが、出血や穿孔事故の可能性は低いので安全性が高いです。
さらにアルゴンプラズマビームは直線方向だけでなく十分に凝固されていない組織抵抗の低いところへもビームが自然と向かっていくので接線方向の焼灼も可能であり、犬猫の狭い気道腔内での処置に有利です。発煙も少ないのでレーザー治療と異なり視野が常に保てます。外径1.5mmの軟性プローブを用いると気管支鏡のチャネルを介して気管支鏡下処置が可能となります。獣医領域でも、ステント内肉芽処置、気道内腫瘍、気道内止血凝固などに適用されています22(図19)。
レーザーほどではないが、処置中の酸素濃度が高い(100%)と出火の可能性が指摘されています23。少なくとも気道内酸素濃度を40%未満、できれば処置中酸素投与は中止し大気濃度とし、出力は40W、ガス流量0.8L/minという環境で気管支鏡下治療に用いられることがすすめられています23。
酸素投与下から、気道内酸素濃度が大気濃度に下がるまでは約30-40秒の時間を要します。また、出火のリスクをもっとも高くするのは連続照射です。レーザー治療に準じると、酸素投与から大気下換気にして30-40秒待ってから処置を開始し、1秒以上の連続照射をしないようにすすめられます24。
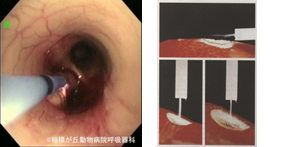
図19|アルゴンプラズマ凝固(APC)。左主気管支内腺癌に対し気管支鏡観察下にAPCを行っている。APCは正面方向のみならず、接線方向も焼灼できるので狭い犬猫の気管気管支内でも実施可能である(左図は、Bolliger CT, Mathur PN. Interventional Bronchoscopy. Basel: Karger, 2000. –p122, Fig.3より転載)
⑤ 高周波スネア
気道内の腫瘤ないしポリープ状病変にスネアワイヤをかけたあと高周波電流を通電し、病変を短時間に切除します25(図20)。処置具はチャネル径2.0mm用のものからあります。高周波発生装置は電気メス装置として手術室に常備されているものが使用されます。モノポーラの原理なので動物には対極板を設置する必要があります。発煙も少なく、採取した腫瘤は組織診断に供することができます。
原則として、有茎性ポリープでその先の気道が開存していることを気管支鏡で確認できることが適応条件です。通電時の出力は、ポリープの大きさ、固さ、部位等に依存すると思われるが、茎部が細くワイヤ締結がほぼ確実に行われれば30-40Wの高出力で1秒以内、比較的広茎性なら10-20Wでワイヤ周囲の組織の凝固色や出血の程度をみながら10-15秒かけて徐々にワイヤを締結していきます。
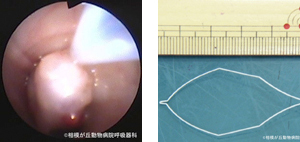
図20|高周波スネア。気管分岐部を閉塞するポリープ状病変基部に高周波スネアをかけて通電している。
⑥ 気管支鏡下エタノール注入
エタノールは強い組織固定作用を有することから腫瘍の増殖抑制や止血に応用可能です。ヒトでは、中枢気道の腫瘍性病変に対して気管支ファイバースコープ下エタノール注入療法(bronchofiberscopic ethanol injection, BEI)が報告されています26。私も猫の中枢気道内腫瘍に対し気管支鏡処置具の吸引生検針を用いてBEI療法を試みた例があります27(図21)。エタノール注入後3日程度で凝固壊死部が生じました。ヒトの報告では生検鉗子でこの部分を除去しさらにエタノール注入を続け繰り返すとありますが、私は硬性鏡の吸引管で吸引して一度に大量に除去できました27。
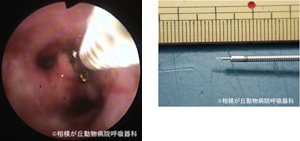
図21|エタノール注入。左主気管支を閉塞する大きな腫瘍に対し吸引生検針(右)を用いて気管支鏡下エタノール注入を行っている。3日後大きな腫瘍壊死片が吸引で摘出できた。
⑦ マイトマイシン塗布
気道ステント前端およびステント内に生じた反応性肉芽に対し、マイトマイシンC(MMC)塗布による縮小化に硬性鏡を用いて試みています。MMCの気道内肉芽に対する縮小効果はヒトで既に報告されています28。MMCは抗がん剤であるため、声帯に接触しないように患部に直接塗布しなければいけません。MMCを十分浸漬した乾綿小片をジャクソン改良直達鉗子で把持し、硬性鏡を通して直接患部に到達させ、1回に4分間鉗子で把持したまま塗布し続けています(図22)。それを一度の処置に5回繰り返しています。
当然この間の換気は維持されています。私は、この処置を2週間ごとに3回継続し、ステント内に隆起状に増殖した肉芽がほぼ消失したことを確認できた1例を経験しました29。気管チューブを介し軟性鏡を用いて同様のことを実施すると換気のスペースを阻害し、長時間の処置は困難となるかもしれません。
また、以下の気道内治療時に気管支鏡は必須です。
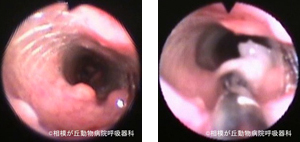
図22|マイトマイシン塗布。気管内ステント内に形成された反応性肉芽腫に対し、硬性気管支鏡とその処置具を用いてマイトマイシン塗布を行っている。12ヶ月後、肉芽はほぼ消失した。
⑧ 気管内ステント留置
近年犬の気管虚脱治療にself-expanding metallic stents (SEMS) による気道ステント設置が行われるようになってきました30-38(図23)。
7-8Frの細いデリバリーシステム内に円筒型メッシュ状のステント材料が装填されているので、声門より抵抗なく挿入できます。まず気管支鏡のチャネルを通しガイドワイヤーを気管に通しワイヤーを留置したまま気管支鏡のみ抜き去り、そのガイドワイヤーにデリバリーシステムを通して透視下に目的部位で展開します。
私の経験では気管虚脱の病態を正確に見極め、適応症例を厳選すれば予後は良好で、3−5年良好に経過しております。しかしエビデンスとされる報告では予後注意とされています。また4年以上経過した症例を集めた報告がなく長期予後不明とされております。現在までの海外報告では誤った症例にステント留置が適用されていたり、留置後の管理が不適切であったりして、残念ながら気管内ステント留置が正しく評価されておりません。
長期予後注意とされている以上、当院では、気道ステント設置後はステント内および端部の肉芽、細菌コロニー観察のため、3−6ヶ月ごとに定期的な気管支鏡検査を行うことが必要と考えております。ステント素材や形状がかなり改良され肉芽形成することはほとんどありませんが、もし肉芽がみつかったとしても上記の気道内治療でその場で切除しておりますし、ステント内喀痰を培養し必要があれば適切な抗生剤を投与します。
図23|気管内ステント留置。上はステント留置前の気管虚脱GradeⅣの胸部X線所見と気管支鏡所見。気管中央部は完全に扁平化している。下はステント留置後。気管は十分拡張している。呼吸困難は劇的に改善した。
⑨ 気道内バルーン拡張
気管支鏡の内部観察のあと、気管狭窄を確認後、ガイドワイヤを介して透視下に適切なサイズのバルーンカテーテルを挿入し、ゆっくり拡張させます(図24)。バルーンを満たす液体は造影剤と生理食塩液を半々の濃度で作成したものを用います。予測される気道径より小さいものからはじめ、拡張時の抵抗、バルーンの拡張時の均等性などにより段階的にサイズの大きいカテーテルでも確認します。
バルーン拡張時には吸入気酸素濃度を100%に上げ、Spo2が減少し始めるまで最大拡張を続けます。良性狭窄でも悪性狭窄でも適応可です。また、拡張後の気道を安定化させるためにステントやTチューブを留置することがあります。
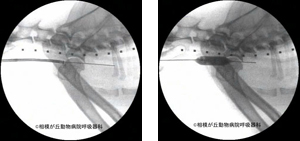
図24|気道内バルーン拡張。猫の良性気管狭窄に対し、気管支鏡を介しガイドワイヤを気管内に留置後(左)、バルーン拡張カテーテルを気道内に誘導し気道拡張を行った(右)。
当院気管支鏡検査の実績は、診療実績をご参照ください。
過去の気管支鏡検査の動画を「気管支鏡検査アーカイブ」で公開しております。
引用文献
- 1.日本小動物内視鏡推進連絡会呼吸器内視鏡分科会. 呼吸器内視鏡ガイドライン. 東京: 日本小動物内視鏡推進連絡会事務局, 2011.
- 2.桝田幹郎, 鈴木隆, 鈴木秀一, et al. 小児気道異物の摘出におけるラリンゲルマスク(Laryngeal mask)の有用性. 気管支学 2004;26:83-87.
- 3.Amis TC, McKiernan BC. Systematic identification of endobronchial anatomy during bronchoscopy in the dog. Am J Vet Res 1986;47:2649-2657.
- 4.城下幸仁, 松田岳人, 佐藤陽子, et al. 犬猫における気管支鏡検査 適応および解剖学的考察. 動物臨床医学会年次大会プロシーディング 2006;27回:200-201.
- 5.城下幸仁, 松田岳人. 胸部レントゲン像における犬の葉・区域気管支の分布と走行. 第25回動物臨床医学会年次大会プロシーディング 2004;No.3, 146-147.
- 6.城下幸仁, 松田岳人, 佐藤陽子, et al. 粘液栓によって胸部X線に限局性肺胞浸潤影のみられた猫の1例. 第26回動物臨床医学会年次大会プロシーディング 2005;No.2, 29-30.
- 7.Hawkins EC, DeNicola DB, Kuehn NF. Bronchoalveolar lavage in the evaluation of pulmonary disease in the dog and cat. State of the art. J Vet Intern Med 1990;4:267-274.
- 8.Hawkins EC. Bronchoalveolar Lavage In: King LG, ed. Textbook of Respiratory Diseases in Dogs and Cats. St.Louis: Saunders, 2004;118-128.
- 9.田村昌士. 気管支肺胞洗浄[BAL]法の臨床ガイドライン. 東京: 克誠堂, 1999.
- 10.城下幸仁. 呼吸困難をともなった猫の下気道感染症の2例. 第5回日本臨床獣医学フォーラム年次大会2003 2003;Vol.5-1, 5-72~73.
- 11.Tenwolde AC, Johnson LR, Hunt GB, et al. The role of bronchoscopy in foreign body removal in dogs and cats: 37 cases (2000-2008). J Vet Intern Med 2010;24:1063-1068.
- 12.Martinot A, Marquette CH, Ramon P, et al. Foreign body aspiration in childhood: management algorithm. Eur J Emerg Med 2000;7:77-78.
- 13.米澤覚, 太田亮, 矢島信一, et al. 胸部気管切開により摘出した猫の気管内異物. 動物臨床医学会年次大会プロシーディング24回2号 2006:129-130.
- 14.Padrid PA, McKiernan BC. Tracheobronchoscopy of the Dog and Cat In: Tams TR, ed. Small Animal Endoscopy. 2nd ed. St.Louis: Mosby, 1999;377-396.
- 15.Goodnight ME, Scansen BA, Kidder AC, et al. Use of a unique method for removal of a foreign body from the trachea of a cat. J Am Vet Med Assoc 2010;237:689-694.
- 16.Tivers MS, Moore AH. Tracheal foreign bodies in the cat and the use of fluoroscopy for removal: 12 cases. J Small Anim Pract 2006;47:155-159.
- 17.Zambelli AB. Pneumomediastinum, pneumothorax and pneumoretroperitoneum following endoscopic retrieval of a tracheal foreign body from a cat. J S Afr Vet Assoc 2006;77:45-50.
- 18.城下幸仁. 気管支鏡にて診断・治療した猫の気管内異物の1例. 動物臨床医学会年次大会プロシーディング 2011;32回:385-386.
- 19.佐藤洋子, 関根和彦, 安倍晋也, et al. 自作透明フードを装着した気管支鏡により摘出できた気道異物の1例. 日本救急医学会雑誌 2009;20:929-934.
- 20.Bolliger CT, Mathur PN. Interventional Bronchoscopy. Basel: Karger, 2000.
- 21.Stedja G, Bolliger CT. Endbronchial Electrocautery and Argon Plasma Coagulation In: Bolliger CT,Mathur PN, eds. Interventional Bronchoscopy Prog Respir Res. Bases: Karger, 2000;120-132.
- 22.城下幸仁. 気管分岐部を閉塞する猫のポリープ型扁平上皮癌に対し気管支鏡下に高周波スネア切除およびアルゴンプラズマ凝固を行い、長期QOL維持可能であった1例. 気管支学(0287-2137) 2013;35:111.
- 23.Colt HG, Crawford SW. In vitro study of the safety limits of bronchoscopic argon plasma coagulation in the presence of airway stents. Respirology 2006;11:643-647.
- 24.佐藤雅美, 近藤丘. 内視鏡下治療の適応と安全性-高出力レーザー治療を安全に施行するために. 日本気管支学会 第13回気管支鏡セミナー 気管支鏡検査-基本、安全性とその進歩. 千葉: 第24回日本気管支学会, 2001;67-79.
- 25.日本気管支学会. 気管支鏡 臨床医のためのテクニックと画像診断. 東京: 医学書院, 1998.
- 26.Fujisawa T, Hongo H, Yamaguchi Y, et al. Intratumoral ethanol injection for malignant tracheobronchial lesions: a new bronchofiberscopic procedure. Endoscopy 1986;18:188-191.
- 27.城下幸仁, 松田岳人, 柳田洋介, et al. 気管分岐部を閉塞する中枢気道内腫瘍に対しinterventional bronchoscopyにて管理した猫の1例. 動物臨床医学会年次大会プロシーディング 2008;29回:135-136.
- 28.根岸宏行, 西根広樹, 石川文月, et al. 気道ステントをめぐる諸問題 pros and cons 肉芽増生による気道狭窄に対するマイトマイシンC局所塗布治療. 気管支学 2007;29:14-19.
- 29.城下幸仁. 気管虚脱の積極的治療法について 外科的治療法VS気管内ステント留置法 気道内ステント留置法. 動物臨床医学会年次大会プロシーディング 2009;30回:303-307.
- 30.城下幸仁. 気管虚脱の診断と治療 ステント. 獣医麻酔外科学雑誌(0916-5908) 2012;43:80-81.
- 31.城下幸仁. 犬の気管虚脱に対する気管内ステント留置. 気管支学(0287-2137) 2013;35:462.
- 32.Moritz A, Schneider M, Bauer N. Management of advanced tracheal collapse in dogs using intraluminal self-expanding biliary wallstents. J Vet Intern Med 2004;18:31-42.
- 33.岩田和也, 千村収一. 気管内ステント(Ultraflex)を留置した重度気管虚脱の犬の1例. 獣医畜産新報 2007;60:216-220.
- 34.城下幸仁, 松田岳人, 佐藤洋子, et al. 犬の気管虚脱GradeIVに自己拡張型金属ステントEasy WallstentTMの気管内留置を試みた1例. 第9回日本臨床獣医学フォーラム年次大会2007 2007;vol.9-1, 6-18~19.
- 35.Kim JY, Han HJ, Yun HY, et al. The safety and efficacy of a new self-expandable intratracheal nitinol stent for the tracheal collapse in dogs. J Vet Sci 2008;9:91-93.
- 36.Kim JH, Shin JH, Song HY, et al. Use of a retrievable metallic stent internally coated with silicone to treat airway obstruction. J Vasc Interv Radiol 2008;19:1208-1214.
- 37.Sun F, Uson J, Ezquerra J, et al. Endotracheal stenting therapy in dogs with tracheal collapse. Vet J 2008;175:186-193.
- 38.Sura PA, Krahwinkel DJ. Self-expanding nitinol stents for the treatment of tracheal collapse in dogs: 12 cases (2001-2004). J Am Vet Med Assoc 2008;232:228-236.
作成日:2014/5/20