Part5 呼吸器疾患各論
C. 気管と気管支
50章 原発性線毛運動不全症
Carol R. Norris
気道は外界からの刺激に対し様々な防衛機構、すなわち機械的な濾過、咳およびくしゃみ反射、粘液線毛装置、体液性および細胞性免疫、食細胞、アルファ1−抗トリプシン、リゾチームおよびラクトフェリンのような抗菌物質などによって保護されている[1]。原発性線毛運動不全症(PCD)は、線毛運動性障害によっておこる先天性疾患のひとつで、粘液線毛装置の機能障害を引き起こす。超微形態異常を伴うことも伴わないこともある[2-4]。粘液線毛装置は、導入気道に衝突する無機・有機的な吸入微粒子やガス物質などの刺激から気道を保護している[5]。粘液線毛装置は、線毛上皮表層、線毛周囲液層(ゾル層)、および表層粘液層(ゲル層)を作る粘液分泌腺と細胞からなっている。線毛上皮は鼻腔と終末細気管支レベルまでの気管気管支樹で認められる[6]。粘液線毛装置は機械的に吸入物質を捕捉し、粘液と異物を線毛運動によって肺から咽頭の方に移動させ喀痰として取り除く。気道から粘液が十分に排出されないと、慢性の粘液栓や炎症と感染を引き起こし、最終的に、鼻副鼻腔炎、気管支炎、気管支拡張症および気管支肺炎という臨床症状に至る。原発性線毛運動不全症は線毛運動不能症候群[6-8]や先天性線毛運動機能障害[9,10]とも呼ばれてきた。カルタゲナー症候群、すなわち内臓逆位(内臓の左右反転)、鼻副鼻腔炎、および気管支拡張症の三徴は、PCDに含まれると考えられる[8]。カルタゲナー症候群は、原発性線毛運動不全症を示す人のおよそ50%に認められた。この症候群は、線毛の超微形態の異常もしくは電顕でも検出しえない機能異常によるものと考えられ、そのどちらも線毛の運動障害や運動停止を起こす[11]。内臓逆位は、線毛の機能障害から胚の軸転を生じその結果内臓の配置決定に異常が生じると推測されている。鼻副鼻腔炎と気管支拡張症は、鼻道、副鼻腔、および気管気管支樹における粘液線毛クリアランスの機能障害の続発症である[7]。
線毛の超微形態
正常な個体では、線毛の複雑な超微形態が線毛の律動的な協調運動を可能にする。1本1本の線毛は、気道の上皮細胞表面から伸びる指様の突起であり、基底小体によって裏打ちされ、細胞膜によって覆われている。気道のひとつの円柱上皮細胞の表面はおよそ200の線毛で覆われている[12]。線毛のアキソネム(芯)は、2本の中心細管が9つの周辺双微細管(図50−1)に囲まれて構成されている。隣接双微細管(doublets)は、内外側のダイニン腕によって連結している。ダイニン腕でATPが加水分解されエネルギーとなったときに、隣接双微細管が相互にslideして線毛が動く[12]。正常な線毛機能においてその他の重要な相互連結構造物にネキシン連結と放射状スポークがある[8]。
図50−1。正常な線毛の横断面図(From Morrison W, Wilsman N, Fox L, et. al.: Primary ciliary dyskinesia in the dog, J Vet Intern Med 1:67-74, 1987)。
Cilliary Membrane: 線毛膜、Outer Dynein Arm: 外ダイニン腕、
Nexin Link: Nexin Link、Inner Dynein Arm: 内ダイニン腕、Microtubules: 微細管、 Central: 中心、A: A、 B: B
犬のPCDでは、線毛の超微形態の様々な異常が発見されてきた。これらの異常には、内側のダイニン腕の欠損、ネキシン連結と放射状スポークの異常、隣接双微細管の位置異常、隣接双微細管または中央細管の不足または過剰、ダイニン腕の短縮、方向性を失った線毛、隣接双微細管と細胞膜の間の線維輪などがある[3,6-8]。超微形態の異常がない人や犬の症例があるようである[4,11]。犬のPCDの遺伝形式は常染色体性劣性であると推測される[13]。
線毛に超微形態や機能に異常のある患者は線毛上皮細胞だけでなく他の器官にも臨床的に異常を示すことがある。犬では、水頭症[1,4,6,10]、腎線維症と遠位尿細管の拡張[7]、精子異常による男性不妊[7,14]、また胸骨や脊椎骨や肋骨の異常[7,14]などがみられる。微小管も好中球の細胞骨格の重要な要素であり微生物の殺滅と貪食を可能にしている[2]。しかし、PCDの犬の研究では好中球の重大な機能障害は発見されていない[2,9]。健康犬の気道の超微形態を調べると、0.4から6.8 %の有病率で線毛異常がみられる[7]。線毛の運動障害がある犬では、構造異常の有病率は100 %にもなると思われる[15]。
疫学と臨床症状
犬のPCDは、イングリッシュポインター、イングリッシュスプリンガースパニエル、イングリッシュセッター、ボーダーコリー、オールドイングリッシュシープドッグ、ドーベルマン・ピンシャー種、チワワ、ゴールデンレトリーバー、ロットワイラー、チャウチャウ、チャイニーズシャー・ペイ、ニューファンドランド、ダルメシア犬、ブルマスチフおよびビションフリーゼなど様々な犬種で診断されている[1,3,4,6-9,13-18]。1, 3, 4, 6-9, 13-18
猫で、卵管の線毛の超微形態異常(気道上皮の線毛は検査されなかった)とCTによる気管支拡張症に基づきPCDと推定診断された例がひとつある。しかし、この猫には呼吸器症状はみられなかった[19,20]。若齢犬で最も多くみられるが[12]、11歳の犬でPCDと推定診断された報告がある[21]。この犬は最初の10年の間呼吸器症状がなかったので、続発性線毛運動不全症であった可能性がある[3]。
若齢犬は膿様粘液性鼻汁と咳を伴う上下気道感染を再発する症状を示す[1,6,7,13,16]。
呼吸困難も時に起こると報告されている[13,17]。呼吸器症状は一般に抗生物質に反応するが、投与中止後に再発する傾向がある。他の器官中でも運動障害の線毛に関する臨床徴候が出現するかもしれない。精神的抑うつ、機能障害の上衣細胞によって引き起こされた水頭症による発作、および線毛を持った耳管の異常により聴力損失および中耳炎などが起こります[12,14]。オス犬は不妊となるかもしれない。
鑑別診断
原発性線毛運動不全症は、続発性線毛運動不全症(SCD)、選択的IgA欠損症のような先天的免疫不全症候群、補体欠損症、および細胞性免疫や好中球の機能の先天的異常と鑑別しなければいけない。これらは全て再発性上下気道感染症を示すことがある[3,12]。SCDの最大の特徴は、様々な後天性疾患(例えば慢性気管支炎、慢性の気道感染、そして間接喫煙を含む有毒傷害)で生じる気道の線毛の超微形態の可逆的損傷である[3,12,22]。基礎疾患が適切に治療されれば、粘膜線毛クリアランス検査を継続して行うとSCDは改善するかもしれないが、PCDの犬では粘膜線毛クリアランス検査は異常なままである[12]。先天性免疫不全症候群の多くは全身感染症にかかりやすく気道に限局しない。
免疫グロブリン定量でこれらの症候群のうちのいくつかを評価できます。例えば、完全溶血性補体アッセイ、リンパ球有糸分裂生起、また好中球の走化性・付着・貪食、およびニトロブルーテトラゾリウム減少アッセイなどの定量法である[1,9]。
診断
血液所見は非特異的であり、二次感染を反映する程度である。したがって成熟した好中球増加による白血球増多症がよくみられる[6,13,14]。胸部X線撮影は、気管気管支樹および肺実質の異常を識別するのに有用である。X線所見は内臓逆位、気管支周囲パターン、間質性あるいは肺胞性浸潤影、および気管支拡張症を示しているかもしれない[1,6-8.12,13,15]。気管支周囲のパターンは気管支炎を反映する。また、慢性の気管支の炎症および感染は、気管支拡張症を引き起こす。気管支拡張症は気道壁への慢性炎症性傷害によってもたらされた異常な不可逆性の気道拡張として定義される[23]。間質性・肺胞性浸潤は、粘液線毛クリアランス障害から継発する細菌性肺炎で生じる場合がある。
気管気管支洗浄(つまり気管内、経気管、あるいは気管支肺胞洗浄)は細胞疹と培養のための検体を得るために使用されることがある[6,8,17]。細胞診の所見では化膿性炎症がしばしばみられ、細胞内または細胞外細菌を伴うことも伴わないこともある[6,8,17]。鼻腔用綿棒または気管気管支洗浄から分離された微生物は連鎖球菌属、マイコプラズマ属、パスツレラ属、アシネトバクター属、ブドウ球菌属、アクチノミセス属、コリネバクテリア属、フラボバクテリウム属、シュードモナス属および大腸菌がある。* 真菌の増殖は現在まで報告されていない。同時に採取した鼻と気管からの材料から同じ細菌が増殖したとの報告がある[14]。その研究の著者らは、鼻の滲出物を培養することにより気道の菌叢をモニターすることを提案した。しかしながら、わずかの動物だけで研究されたにすぎず、定量的データもなく、気管支でなく気管洗浄が行なわれていた。したがって、ルーチン検査としてこれを推奨するにはさらなる研究を行なう必要がある。
オス犬において、精子の鞭毛[4]は線毛の変形であるので、微小管の異常を評価するために精子が収集された。精子の鞭毛中の微小管の配置は気道上皮細胞の線毛の配列と同じである[14]。PCDの犬では、精子は動かないか[15]、活動力が低下し生殖不能になる[4,13]と報告された。気道の線毛運動障害のある人で正常に動く精子が報告された[14]。
99−テクノチウムマクロ凝集アルブミン(99Tc-MAA)を使用する粘液線毛シンチグラフィーは粘液線毛装置の生体内での機能的状態を評価するために使用できる。粘液線毛輸送機能小滴テストは、患者に麻酔をかけ挿管し、ポリスチレン・カテーテルから放射性の小滴を注入し、カテーテルと気管内チューブの両方をいっしょに抜き、ガンマカメラを使用して粒子の速度をモニターすることにより行なわれる。静止画像は5分ごとに合計30分間得ることができる。PCDでは、30分間観察を続けても小滴は気管分岐部より頭側に動くかない(図50−2)。このテストは臨床症状を示した犬にPCDの確定診断をするために使用されてきた[1,3,4,13]。疑陽性が、続発性線毛運動不全症で、あるいは二次気管支に放射性物質が沈着して生じる場合がある[22]。粘膜線毛クリアランスが正常な速度でみられる動物では、PCDは類症鑑別のリストから除去できる。
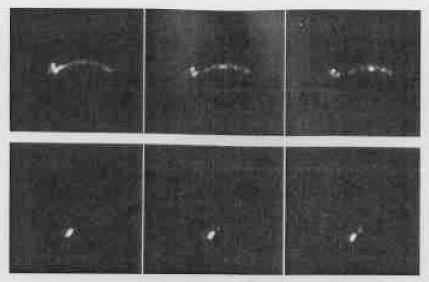
図50−2。正常な犬(上)およびPCDの犬(下)の粘液線毛シンチグラフィー。上列の犬は、滴下注入から咽頭に向かって放射性小滴の効果的な粘膜線毛クリアランスを示している。下列の犬は、放射性小滴が移動していない。連続するイメージは5分ごとに得られたものである(写真は、カルフォルニア大学デイビス校Ned K. Waters氏の好意による)。
PCDの超微形態の異常所見は組織の電顕検査によっている。鼻や気管粘膜の生検は多くの場合最も容易に採取できる組織で、直ちにグルタルアルデヒドで固定しなければならない。それから線毛の異常の定量および記述を行なうことができる。
線毛運動周波数と同期性がコンピュータ化された顕微鏡測光を使用して生検標本で評価された[3,13]。この方法により、PCD犬および正常な犬の大多数の線毛は実際には動いていることを実証した。したがって、「線毛運動不能症候群」という用語は恐らく誤っている[4,13-15]。協調運動障害のある(運動機能障害のある)線毛の動きは超微形態の異常[3]と密接な関係があり、重度な粘液線毛装置の機能不全になる。
線毛再生(Ciliogenesis)は、鼻の粘膜生検、気管の粘膜生検、あるいは気管支の粘膜生検からの上皮細胞を使用したin vitroの培養技法である[3]。細胞は、一層で成長し、融合・鱗状になり、線毛を失う。その後、線毛を失った細胞は懸濁液中に入り、ここで線毛を再生成する。これらの細胞は電子顕微鏡検査を使用して超微形態の変化を評価される。PCDの患者は線毛発生の後も超微形態の異常を維持する。対照的にSCDでの二次性の異常は線毛再生の後に失われる。
--------------------------------------------------------------
* 4、6、8、10、12および17を参照。
治療
再発を繰り返す鼻道、副鼻腔および気管気管支樹の二次性の細菌感染は抗生物質治療を必要とする。抗生物質の選択は培養および感受性試験に基づくべきである。粘液線毛装置の障害がある場合、咳嗽は肺から微粒子物および微生物を取り除くに最も重要な防御機構のうちの1つになる。したがって、鎮咳薬は避けるべきである[12]。たばこの煙、ダストあるいはエアゾール剤のような刺激物への環境暴露を最小限にすることは機能障害のある粘液線毛装置の負担を最小限にできることにもなる。
予後
線毛の機能不全は軽度から重度まであり、軽症の犬なら治療は最小限でよい。重症の動物では、二次性の細菌性肺炎の管理がPCD管理の成功の鍵である。多くの犬が、反復感染と慢性炎症から気管支拡張症になる。これはさらに肺炎を進行させてしまう。若い年齢で重度な細菌性気管支肺炎になると死亡したり安楽死させられたりする動物があるが、二次性の細菌感染を適切に治療すれば、この病気でも犬は数年間生きられるかもしれない。
引用文献
1. Dhein C, Prieur D, Riggs M et al: Suspected ciliary dysfunction in Chinese shar-pei pups with pneumonia, Am J Vet Res -51:439-446, 1990.
2. Morrison W, Frank D, Roth J et al: Assessment of neutrophil func?tion in dogs with primary ciliary dyskinesia, J Am Vet Med Assoc 191:425-430, 1987.
3. Clercx C, Peeters D, Beths T et al: Use of ciliogenesis in the diag?nosis of primary ciliary dyskinesia in a dog, J Am Vet Med Assoc 217:1681-1685, 2000.
4. Edwards D, Kennedy J, Toal R et al: Kartagener's syndrome in a chow chow dog with normal ciliary ultrastructure, Vet Pathol 26:338?340, 1989.
5. Wanner A, Salathe M, O'Riordan T: Mucociliary clearance in the airways, Am J Respir Crit Care Med 154:1868-1902, 1996.
6. Edwards D, Patton C, Bemis D et al: Immotile cilia syndrome in three dogs from a litter, J Am Vet Med Assoc 183:667-672, 1983.
7. Afezelius B, Carlsten J, Karlsson S: Clinical, pathologic, and ultra?structural features of situs inversus and immotile-cilia syndrome in a dog, J Am Vet Med Assoc 184:560-563, 1984.
8. Randolph J, Castleman W: Immotile cilia syndrome in two Old English sheepdog litter-mates, J Small Anim Pract 25:679-686, 1984.
9. Maddux J, Edwards D, Barnhill M et al: Neutrophil function in dogs with congenital ciliary dyskinesia, Vet Pathol 28:347-353, 1991.
10. Daniel G, Edwards D, Harvey R et al: Communicating hydro?cephalus in dogs with congenital ciliary dysfunction, Dev Neurosci 17:230-235, 1995.
11. Herzon F, Murphy S:
12. Crager C: Canine primary ciliary dyskinesia, Comp Contin Ed 14:1440-1444, 1992.
13. Edwards D, Kennedy J, Patton C et al: Familial immotile-cilia syn?drome in English springer spaniel dogs, Am J Med Genet 33:290?298, 1989.
14. Morrison W, Wilsman N, Fox L et al: Primary ciliary dyskinesia in the dog, J Vet Intern Med 1:67-74, 1987.
15. Wilsman N, Morrison W, Farnum C et al: Microtubular protofila?ments and subunits of the outer dynein arm in cilia from dogs with primary ciliary dyskinesia, Am Rev Respir Dis 135:137-143, 1987.
16. Carrig C, Suter P, Ewing G et al: Primarv dextrocardia with situs in?versus, associated with sinusitis and bronchitis in a dog, J Am Vet Med Assoc 164:1127-1134, 1974.
17. Hoover J, Howard-Martin M, Bahr R: Chronic bronchitis, bronchiectasis, bronchiolitis, bronchiolitis obliterans, and bron?chopneumonia in a rottweiler with primary ciliary dyskinesia, J Amer Anna Hosp Assoc 25:297-304, 1989.
18. Watson P, Herretage M, Sargas D: Primary ciliary dyskinesia in
19. Roperto F, Saviano R, Guarino G: Atypical basal bodies in a cat with immotile-cilia syndrome, J Submicrosc Cytol Pathol 26:565-567, 1994.
20. Roperto F, Brunetti A, Saviano L et al: Morphologic alterations in the cilia of a cat, Vet Pathol 33:460-462, 1996.
21. Killingsworth C, Slocombe R, Wilsman N: Immotile cilia svndrome in an aged dog, J Am Vet Med Assoc 12:1567-1571, 1987.
22. Toal R, Edwards D: Mucociliary scintigraphy. In Berry C, Daniel G, editors: Handbook of veterinary nuclear medicine,
23. Norris C, Samii V: Clinical, radiographic, and pathologic features of bronchiectasis in cats: 12 cases (1987-1999), J Am Vet Med Assoc 216:530-534, 2000.