
Part1 呼吸器病の問題へのアプローチ
5章 上気道閉塞、いびき様喘鳴(stertor)、およびストライダー
David E. Holt
定義と臨床徴候
軽度から非常に重度な上気道閉塞は小動物診療でしばしばみられる。本章では、上気道を、鼻道、後鼻孔、鼻咽頭、口、咽頭口腔部、喉頭および気管と定義する。多くの種々の病気によって上気道の解剖学的構造が冒され、閉塞および呼吸機能障害が引き起される。いびき様喘鳴(stertor)はヒトではいびきに類似する雑音として定義される。猫は、犬が運動したりパンティングしていないときのように、主に鼻で呼吸する。いびき様喘鳴(stertor)は、鼻呼吸中の鼻道、後鼻孔あるいは鼻咽頭の部分閉塞と関係していると思われる。ストライダーは、吸気で通常聞かれる荒く高音調の呼吸音である。ストライダー性呼吸は、喉頭と気管を冒す病気(例えば犬の喉頭麻痺)でしばしばみられる。
臨床徴候の性質と程度は、気道の閉塞部位と重症度によって決まる。軽度の上気道閉塞を示す動物では、いびき様喘鳴(stertor)かストライダー様のわずかな吸気時喘鳴音が唯一の検知できる異常である。鼻腔内腫瘍によって重度な鼻道閉塞を示した犬でさえ、上気道閉塞の臨床徴候は明らかではないことがある。これらの犬は単に口呼吸するだけで、飼い主に異常として認められない。上気道閉塞が悪化してくると、吸気性または時に呼気性呼吸筋はより強く収縮する。通常、呼吸の吸気相は延長し、このことが大きないびき様喘鳴またはストライダーの雑音に関係する。罹患した犬は、気道抵抗を減少させるために、頚を延ばして起立し肘を外転させる特徴的な姿勢をとる。猫は、頚を伸ばして座り口を開いて呼吸することがある。重症例では、舌はチアノーゼを呈することもある。舌表面を通過する気流が減少するために、高熱が生じることがある。重度の上気道閉塞を示す動物は、しばしば非常に苦しむ。重度な呼吸困難が長引くと、動物は消耗したり虚脱するようになったり、あるいは時に高熱による二次性の発作も起こりうる。
上気道閉塞の性質および位置によって他の臨床徴候が起こりうる。腫瘍、異物あるいはポリープによる、尾側鼻道、後鼻孔、あるいは鼻咽頭前部の閉塞は、漿液性から粘液膿性の鼻汁を引き起す場合がある。鼻の真菌または腫瘍性病変はしばしば間欠性の鼻出血を引起す。犬猫の鼻腔内腫瘍および猫のクリプトコックス感染症では、鼻、顎、または前頭骨のゆがみが生じることがある。鼻腔内あるいは前頭洞腫瘍は、前頭骨、硬口蓋、および涙骨を侵し、球後隙に侵入し眼球突出症を引起すこともある。咽頭腫瘍と粘液瘤腫は腫脹部位が見え、嚥下困難を引起す場合がある。犬では、喉頭麻痺は全身性末梢神経障害のたった1つの症状発現であることがあり、詳細な検査で固有受容感覚欠損が明らかになることがある。
一般的な病態生理
正常な犬では、鼻は吸気時の全気道抵抗の80%を占めている[1]。鼻腔内のほとんどは、非常に血管豊富な上皮で覆われた渦巻状の鼻甲介骨で満たされるので、このことは容易に理解できる[2].鼻の気流に対する抵抗は、効果的な嗅覚および熱交換に必要な乱流を引き起こす。対照的に、上気道の他の部分は正常な犬では吸気時の気道抵抗にはほとんど関与していない[1]。したがって、鼻道または鼻咽頭閉塞のため呼吸困難を示す犬は気道抵抗を最小限にするために口呼吸だけする。上気道の閉塞性障害では、主として病変部の気道半径の減少により気流抵抗が増加している。上気道閉塞における気道半径の重要性はポアズイユの法則[3]から理解することができる:
Q=π×ΔP×r4/8×L×N つまり、気流(Q)の速さは、気道の半径の4乗(r4)に比例する。
P=気道両末端間の圧力差; N=ガスの粘性; L=気道の長さ。
喉頭や気管などの気道の断面半径が半分に減少すると、気道中の気流は1/16に減少することが明らかである(すなわち1/2の4乗=1/16)。
抵抗増加に応じて、吸息筋は各呼吸ごとに正常より長く収縮し、吸気時間を延長する。この反応は、ヘーリング・ブロイエル反射[4]によって介在されると思われる。恐らく呼吸困難の意識的な感覚および筋紡錘の刺激によって吸息筋短縮力が増加する。他のメカニズムによる代償が不十分なとき、炭酸ガス分圧(Paco2)の上昇と動脈血酸素分圧(Pao2)の減少による強力な化学性フィードバック作用により呼吸努力がさらに刺激される。上気道閉塞で換気が減少すると、炭酸ガス分圧のわずかの増加でも分時換気量(例えばヒトでの炭酸ガス分圧の1Torrの増加につき2.5L/minの増加)を大きくするように動物を刺激するだろう[5]。
吸気努力が主要な問題である上気道閉塞でも、1回換気量を回復するために呼気筋も補強される[5]。呼気筋は終末呼気量を受動的な機能的残気量より下げようとし、吸気のための胸壁の弾性エネルギーを蓄える。このことは吸息筋収縮の前にかなりの吸気気流を生じさせる。
肋間筋および横隔膜の過剰収縮が長期間継続すると、筋疲労と機能不全が生じることがある。これは人の医学のよく認められた問題である。必要以上の筋肉が吸気を助けるために補充される。横隔膜が強力に収縮すると、特に横隔膜の収縮力が肋間筋収縮によって妨げられない場合、尾側肋骨は内方に牽引される。横隔膜は腹部臓器を後方に押しながら、腹腔前部へ収縮する。腹部は外方に動きながら、胸壁は吸気時に内方へ動くように思われる。呼息を助けるために補充される腹筋は収縮し腹部は呼息時に内方へ動く。その一方で胸部は、外へ動くように見える。胸壁と腹壁が呼吸の異なる相に逆説的に動くので、この臨床所見は奇異呼吸と名付けられている。奇異呼吸は、重度な呼吸困難、呼吸仕事量増加および呼吸筋疲労の明瞭な徴候である。
通常、代償機構は上気道閉塞を示す動物において暫くの間換気を維持する。しかしながら、かなりの低酸素が生じる場合がある。重度な犬の喉頭麻痺の中等度例と重症例とでは、コントロールの91mmHgに比べ、Pao2値はそれぞれ80±3と51±7mmHgだった[8]。Paco2値は両方のグループとも正常範囲内にあった。吸気・呼気筋による呼吸仕事の増加は、多大な熱を生成する。呼吸仕事の増加は、暑さと運動と重なると、しばしば喉頭麻痺の犬で代償不全を促進し、激しい高熱を引き起こすことがある。
短頭種気道症候群については別章にて詳細に記述されている。しかしながら、関連する上気道閉塞の病態生理学は本章で議論しておく。短頭種の犬には、外鼻孔狭窄[8]、軟口蓋過長[9]、およびしばしば気管低形成[10]により多大な気流抵抗が生じる。さらに、ブルドッグ(おそらく他の短頭種でも)には、上気道を狭くする過度の咽頭軟部組織がみられる。覚醒時には、ブルドッグは、呼吸ごとに咽頭を拡大するために胸骨舌骨筋を活動亢進させている。これらの筋の活動は、非短頭種の同じ筋でみられるものより大きい。REM睡眠時、無呼吸は咽頭拡張筋の活動が低下することに関係している。無呼吸は、咽頭拡張筋活動の突発性再開によって終了する。これらの筋活動の突発性再開は、拡張筋の浮腫および線維化に関係している[11-13]。
筋の線維化の経年的進行はブルドッグが吸息時に気道を拡大することができにくくなることを意味すると思われる。部分的な上気道閉塞が長期化すると、外側喉頭室の粘膜の外反(喉頭小嚢外反)が生じる短頭種がある[14]。気流抵抗を克服しようとするために気道内陰圧が上昇していくと、外側喉頭室を裏打ちする粘膜が引き出される。粘膜上の乱気流は浮腫と腫脹を引き起こす。この膨張した粘膜は、声門の50%以上を閉塞することができる。長期化すると、短頭種の喉頭軟骨は脆弱化し、喉頭は次第に虚脱していくことがある。
重度の急性上気道閉塞を示した動物は非心原性肺水腫に進展するリスクがある[17]。上気道閉塞に継発するこの肺水腫症候群は人でも生じるが、まだ完全に理解されていない[18-21]。浮腫形成のメカニズムの仮説は次のようなものである:
1. 上気道閉塞に対して吸気時胸腔内陰圧の著しい上昇[18]。極端な陰圧は心臓への静脈還流量を増加させて、肺動脈圧を増加させるかもしれない。同時に、この胸腔内陰圧は、肺間質および肺胞へ肺毛細管からの液体の流入を起こしやすくする肺胞-毛細血管膜を介する圧勾配をつくる。筋が通っているようであるが、この仮説では、なぜ閉塞のエピソード中というより気道閉塞の軽減後に浮腫が最もしばしば発展するかが説明されない。
2. 毛細血管壁の機械的な破壊による肺毛細血管の透過性の増加[21]。最近、明白な肺出血が上気道閉塞に継発することが報告された[21]。多分、ヒトの患者に報告されたこの肺出血は、肺水腫を引き起こすのと同じ機序でより重度な症状発現を起こしたものであろう。毛細血管壁ストレス(wall stress)増加に継発する肺毛細血管の破壊が示唆された。壁ストレスは次のように定義される: 壁ストレス=毛細血管の経壁圧×脈管の半径/血管壁の厚さ。実験犬モデルでは、肺毛細血管の壁ストレス機能不全が70mm Hgの毛細血管圧の径壁圧で生じた[22]。
3. 毛細血管透過性の上昇は、重度な低酸素に継発して生じるかもしれない[20]。
上気道閉塞を示す動物では、ギャギング/レッチング、逆流あるいは嘔吐などの問題が同時にみられることがある。いくつかの症例では、これらの問題は、直接上気道閉塞(例えば、咽頭尾側部の異物穿通はギャギングを引き起こす場合があり、それによる腫脹は部分的な上気道閉塞を引き起こす場合がある)に関係するものである。咽頭喉頭の刺激がギャギングまたはレッチングのエピソードを引き起こすと推定されることもある。これは、上気道矯正手術前の短頭種犬のおよそ10%で報告される。重度な場合、動物は、ギャギングまたは嘔吐の後の呼吸・心停止を起こすかもしれない; これは、恐らく非常に強い迷走神経刺激によって引き起こされる。
呼吸困難を示す動物では、吐出は、胸部のX線上の空気で満たされた食道あるいは裂孔ヘルニアと関係していることもある。裂孔ヘルニアは喉頭麻痺に合併して生じるとされてきたが、裂孔自体は多くの場合解剖学的に正常である。多分、胸膜内で生成された強い陰圧が、胸部へ噴門と胃底の一部を牽引している。尾側食道括約筋が胸部へ頭方に移動すると、その機能は低下し胃食道逆流が生じる場合がある。胃食道逆流は、犬の自然発症[24]および実験的[25]裂孔ヘルニアでみられた。また、合併する逆流性食道炎は食道の運動性[26]を減少させ得る。裂孔ヘルニアは、通常、上気道閉塞治療の成功とともに消失する。しかし、残存食道炎の対症療法を必要とする例もある。
上気道閉塞と嘔吐、あるいは逆流を合併した動物には誤嚥のリスクがあり、それは喉頭麻痺を持った犬に最も一般にみられる[27-29]。これらの動物は反回神経変性が喉頭の内転筋および外転筋の両方に影響するので、嚥下と嘔吐の時に喉頭を内転させることができない。呼吸筋疲労を示す人では、咳メカニズムは減退する。上気道閉塞や重度の努力呼吸を示す動物でも、咳反射が減じるかもしれない。呼吸筋が弱った人では粘膜毛様体クリアランスが減少し[30]、無気肺にもなりやすく[31]、そのため肺炎を起こしやすい。
鑑別診断
さまざまな疾病が上部呼吸路の異なる部分に病変を形成し、いびき様喘鳴(stertor)あるいはストライダーおよび部分的な上気道閉塞を引起しうる。ある特定の犬種(例えば、喉頭麻痺は高齢の大型犬種)でよく生じる疾病もある。徴候と臨床症状だけで診断しがちであるが、上気道疾患には同一とは言えないまでも同様の臨床徴候を示すものが多い。上気道閉塞の動物を評価する際には、臨床家は虚心坦懐に詳細な検査を行うようにしなければならず、また多くの鑑別リストをあげられるようにしておかねばならない。
いびき様喘鳴は、鼻道、後鼻孔、および鼻咽頭の異常を示す疾患と関係がある。重度ないびき様喘鳴(stertor)を引起すような犬の鼻の疾病には、腫瘍、真菌感染症(アスペルギルス症がもっとも多い)、外傷などがあり、ときに、重度な歯の疾病や吸入異物による鼻炎もある[32]。猫では、ヘルペスあるいはカリシウイルス感染による重度なウイルス性鼻炎、腫瘍、クリプトコッカス感染および重度な慢性細菌性鼻炎が、いびき様喘鳴をともなうことがある[33].
獣医学の文献では 後鼻孔疾病の報告は少ない。しかしながら、この部位を冒す病気はほぼ常に上気道閉塞徴候を示す。犬では、鼻腔内腫瘍は後鼻孔へ伸びることがある。先天性閉鎖[34]、異物[35]、および外傷の二次性の瘢痕もまたこの領域を閉塞することがある。後鼻孔の膜性閉塞がいくつかの猫で報告されており、鼻咽頭の狭窄[36-38]と呼ばれている。
犬の気道閉塞症状をともなう可能性のある鼻咽頭・咽頭の疾病には、腫瘍、異物貫通[39]および続発性膿瘍、および粘液瘤腫[40]などがある。猫では、鼻咽頭ポリープ[41]および草の異物[42]がいびき様喘鳴にともなって生じているようである。たまに、原発性の口腔内腫瘍が犬猫に呼吸困難を生じるほど拡大することがある。しかしながら、大多数のこれらの症例では、口腔内腫瘍の主要徴候はえん下障害、よだれ、口臭および血性の口腔内分泌物である。扁桃腺の扁平上皮癌は、他の腫瘍と異なる活動をするために特に診断される可能性があるといえる。多くの場合、原発の扁桃腺腫瘍は小さい。しかし、付属リンパ節の転移性病巣は大きく[43]、咽頭、喉頭および気管を圧迫することがある。
短頭種気道症候群は、ブルドッグ、ボストンテリアおよびパグで、いびき様喘鳴およびストライダーなどを引き起こす。高齢で重度なストライダーを示す大型犬では、後天性の喉頭麻痺を疑わなければいけない。若いブービエ、ハスキー、ロットワイラーおよびダルメシアンの著しい吸気性呼吸困難は先天性の喉頭麻痺に関係していることがある。先天性の声門下狭窄が1頭の犬で報告されている[44]。異物か昆虫吸入、喉頭部の外傷および膿瘍もすべて考慮されるべきである。喉頭閉塞は、抗凝固薬中毒のまれな症状としても報告されている[44]。前縦隔や頸部の腫瘍あるいは膿瘍が反回神経機能に影響する場合がある。喉頭腫瘍[46]、および特に甲状腺腫瘍[47]は、喉頭麻痺に相当する臨床徴候を引き起こすことがある。甲状腺癌は頚部筋組織、食道、気管および喉頭に浸潤し、その結果吸気性喘鳴[47]を引き起こすことがある。
猫では、喉頭麻痺、炎症性肉芽腫性の喉頭疾患および喉頭・気管のリンパ肉腫は、臨床徴候の原因と見なされるべきである。他の気管新生物、異物および気管裂傷は喉頭麻痺と似ている徴候を引き起こす場合がある。猫では、挿管による気管穿孔が上気道閉塞徴候を引き起こす場合がある。麻酔後の回復期に進行性の皮下気腫を伴った呼吸困難が認められた場合に、この状態を疑うべきである[48,49].
気管気管支の異物[50]あるいは腫瘍[51]、気管の好酸球性肉芽腫[52]、気管の寄生虫症[53,54]、抗凝固性殺鼠剤中毒、気管のポリープ[56]および気管のハエウジ症[57]はすべて、上気道閉塞の徴候を引き起こす場合がある。食道異物や縦隔腫瘍、膿瘍あるいは血腫による胸部気管の圧迫も同様の徴候を引き起こす。気管虚脱の動物では通常、間欠性で、慢性の、甲高い咳を示すが、急性代償不全や気道閉塞症状の症例では身体検査で明らかでないことがある。
非心原性肺水腫や吸引性肺炎などの上気道閉塞と共にしばしば生じる合併症も考慮されるべきである。喉頭麻痺を示す動物は、中枢および末梢神経疾患を起こす理由について検査されるべきである。
診断のための検査および初期治療
上気道閉塞を示す動物には、診断のための検査と初期治療を同時に行わなければならない。これらの動物の多くはそれらの生理学的な予備を使い果たしており安定していない。頚静脈静脈穿刺および胸部のX線撮影などの保定を要するルーチン診断手技によって、呼吸症状を急性に悪化することを引き起こす場合がある。したがって、呼吸困難の動物は注意深く評価されなかればならないし、診断のための検査はひとつひとつ段階的に行わなければいけない。
軽度から中程度のいびき様喘鳴あるいは喘鳴を示す動物は、一般に鎮静または酸素投与の必要なく検査することができる。詳細な病歴聴取中に、臨床医は動物の呼吸の数、パターンおよび努力を観察することができる。いびき様喘鳴を示す例では、外鼻孔を注意深く調べなければいけない。いびき様喘鳴、粘液膿性または出血性鼻汁、鼻鏡の脱色などの病歴のある犬では、鼻の真菌感染症を高度に示唆する。鼻腔内腫瘍や前頭洞腫瘍では犬の顔の変形をしばしば引き起こすので、顔の対称性が評価される。猫では、顔の変形は腫瘍あるいはクリプトコックス感染に関係している。動物の口を優しく開き、硬口蓋、軟口蓋、咽頭および扁桃を調べる。口の検査は注意して行う。口の中の広範囲の操作および触診は、強い迷走神経刺激を引き起こす場合がある。従順な猫では、鼻咽頭のポリープの存在は、硬口蓋から軟口蓋に沿って尾方に示指をずらすことにより検知することができる。正常な猫では、指は、硬口蓋の尾側端で背部でスリップするだろう。鼻咽頭ポリープの猫では、ポリープは軟口蓋を腹方に押しているので、多くの場合容易に触知可能である。唾液腺、リンパ節、咽頭、喉頭および気管を優しく触れてみる。喉頭、気管および肺を聴診する。心臓を聴診し、脈を評価する。腹部および末梢リンパ節を触れてみる。喉頭麻痺の動物では、中枢あるいは末梢神経ニューロパシーの示す所見があるか評価するために神経学的検査が行なわれる。病歴と理学所見からの所見に基づいて、血液検査および胸・頚部のX線像などの診断のためのさらなる検査を計画することができる。鼻や頭部X線像、コンピューター化体軸断層写真(CATスキャン)、喉頭鏡検査および咽頭鏡検査などの診断のための検査には、全身麻酔を必要とするものがある。
重度な喘鳴および気道閉塞症状の動物では、多くの場合おおまかな検査以上のことを行なうのは困難である。未知の環境および取扱いによるストレスは、これらの動物を代償不全にしたり呼吸停止を引き起こしたりする場合がある。そのような症例を管理するには、動物がさらなる診断手技に耐えられるように安定化させることをまず第一の目標とする。静脈留置は重度な呼吸困難を示す動物においては必ず行うべきである。静脈内カテーテルは最小の保定下で設置固定されるべきである。酸素は、テント、マスクあるいは酸素ケージで投与することができる。重度な気道閉塞症状を示す動物では、酸素投与しても呼吸困難を軽減しないこともあるかもしれない。心疾患も肺疾患もない異常高熱の動物では、冷たい経静脈輸液の急速投与(10ml/kg)は深部温度を下げるために投与される。必要に応じ、氷嚢やファンを使用したり、動物を濡らしたりする外部冷却も考慮されるべきである。
動物によっては、アセチルプロマジン・マレイン酸エステル(0.01〜0.05mg/kg)の静脈内投与によく反応する。これは呼吸促迫の実質が呼吸困難感および関連するパニックによるかもしれないことを示している。パニックによる呼吸努力や胸腔内陰圧の上昇は、気道虚脱を悪化させる結果となる。パルスオキシメトリは動物がプローブの設置を許容する場合に、ヘモグロビンの酸素飽和度を評価するのに有用と思われる。重度呼吸困難の動物でも、迅速であるが完全な身体検査が可能となる程度に安定することもある。しかし、動物に麻酔を施し挿管して始めて、身体検査および診断のための追加検査を行なうことができる場合もある。
麻酔導入と挿管の方法は、気道管理の緊急性に依存するであろう。すべての動物に迷走神経性心停止を防ぐために抗コリン作用薬を前投与すべきである。軽度から中等度の喘鳴を示す動物では、喉頭の機能(15章と41章を参照)の検査に耐えられるだけの最低量の注射麻酔薬の急速投与で導入することができる。上気道性喘鳴で重度な呼吸困難を示す動物ではただちに気道を確保することが最優先事項である。これらの動物では、もし呼吸促迫を悪化させなければ、頚部腹側面は麻酔導入の前に毛刈りしておくべきである。経口的に挿管可能でない場合、外科医および気管切開術キットを準備する必要がある。気管内チューブには様々なタイプおよびサイズがある。いくつかの症例では、気管切開術が行なわれるまで、中から大サイズのゴムチューブを半閉塞した喉頭あるいは気管に通せば有効換気量と酸素化が維持できる。挿管は、光源をもち適切な大きさの喉頭鏡用いてはじめて試みられるべきである。
有効かつ完全に機能する気道が確保されれば、診断のための追加検査を論理的順序で進めることができる。同時に、換気とガス交換の正確な評価を可能にするための適切なモニタリングを実施することができる。動脈カテーテルは血液ガス分析のサンプリングおよび血圧の直接モニタリングのために設置するべきである。パルスオキシメータープローブは舌に設置する。終末呼気炭酸ガスも測定する。胸部X線像は、肺に肺炎また肺水腫があるか評価するために撮影する。誤嚥性肺炎のX線の変化は、腹側前方の肺野にエアーブロンコグラム伴う肺胞パターンを示す。上気道閉塞に伴う非心原性肺水腫を生じた動物は、肺野後背領域に間質性あるいは肺胞浸潤影を持つ傾向がある[17]。誤嚥性肺炎が疑われる場合、経気管洗浄が無菌の気管内チューブを介して行なわれる。
いびき様喘鳴が主症状であれば、診断のための検査は鼻のX線像と鼻腔鏡検査を行う。軟性鏡による後鼻孔および鼻咽頭の観察が指示される。鼻咽頭は、卵巣つり出し鉤で軟口蓋を牽引して部分的に直接観察することができる。明らかな病変は、内視鏡生検ポートを通じてか、あるいは盲目的にX線像から測定された深さまで鼻から挿入されたカップ鉗子を使用して、バイオプシーを行う。ある症例には、診断のための生検サンプルを、片側の鼻孔を閉塞しながら、生理食塩水で反対の鼻孔に球状注射器を設置し強力にフラッシュすることにより得ることができる。サンプルは咽頭後部から回収される。身体検査、喉頭鏡検査、咽頭鏡検査あるいは胸部のX線撮影でも診断できないストライダーを示す症例には、気管気管支鏡検査が行なわれる。
ほとんどの症例では、診断と同時に気道閉塞症状の根本原因を確定的に治療することが重要である。例えば短頭犬種では、麻酔導入と視診直後に外鼻孔狭窄は広げ、軟口蓋は切除されるべきである。鼻咽頭ポリープと診断された猫では、ポリープを切除し、腹側鼓室胞骨切り術を行う。ある症例(例えば喉頭麻痺の犬)には、緊急治療が外科医の経験により行われる。即時の矯正が可能でなければ、一時的な気管切開チューブ設置により麻酔回復中に気道を確保できるだろう。気管虚脱の犬では、麻酔に先立って多くの場合診断されているか、少なくとも強く疑われている。もし必要であると考えられれば、手術またはステント留置を状況に応じ予定しておくが、気管虚脱の犬では気管切開は行うべきではない。
気管切開は、管理された状況下で最も適切に行なわれる。動物は仰臥にて保定して挿管し、頚部腹側を毛刈りして無菌手術の準備を施す(図5-1)。皮膚切開を、腹側正中線上で動物の大きさにより輪状軟骨から尾方に4〜10cmの長さで行う。胸骨舌骨筋を正中で分離し左右に牽引する。モノフィラメント縫合糸を、予定された気管切開部のすぐ前端と尾端にある気管軟骨を通して設置させられる。また、縫合糸は結節を作り長く糸を残しておく。

図5-1。ブルドッグを仰臥に保定し気管切開術の準備をした様子(写真はDaniel Brockman氏の好意による)。
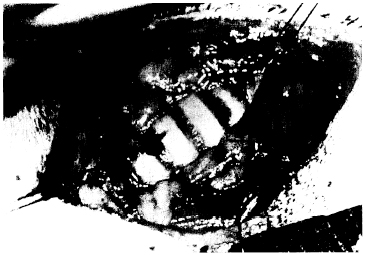
図5-2。モノフィラメント縫合糸を、予定された気管切開部のすぐ前端と尾端にある気管軟骨を通して設置した。縫合糸は結節を作り長く糸を残しておく。これらの縫合糸は、必要ならば気管切開チューブの交換を容易にするように気管切開孔を切り広げられるようにしている。

図5-3。輪状軟骨より少なくとも3リング尾側の気管軟骨輪間の輪状靭帯に横切開を加える。
これらの縫合糸は、必要ならば気管切開チューブの交換を容易にするように気管切開孔を切り広げられるようにしている(図 5-2)。気管内チューブのカフを抜き、輪状軟骨より少なくとも3リング尾側の気管軟骨輪間の輪状靭帯に横切開を加える(図5-3)。実験では、気管全周の3分の1の切開で気管は5%未満の直径減少程度で修復された[58]。臨床的には、気管の円周のサイズの半分の気管切開術切開でも合併症がないように思える。
気管切開チューブは気管直径の75%以下にすべきである。当初の上気道の問題(例えば、腫脹、軟口蓋過長)が十分に回復したかどうか評価するために、チューブを塞いで呼吸が可能か、すなわち気管切開チューブを抜いてもどうか確認できるようにしておくのが理想的である。チューブは、陽圧換気が必要ならカフ付きを用い、管の内側を清掃しやすいものを使用すべきである(図5-4)。気管内の血液と分泌物を吸引してから気管切開チューブを挿入する。チューブは頚部皮膚には縫合糸で、頚部周囲には臍帯テープで固定する。短頭種犬では、滑脱しないようにチューブを気管に緩く縫合することが必要になることがある。垂直および横断のフラップ気管切開術が犬で記述されているが、上記の横切開による気管切開術に優る長所があるようには思えない[59,60].
上気道を介さず気管切開チューブから入る空気は加温も、加湿も、ろ過もされない。乾燥した冷たいガスを吸入すると、濃厚で粘稠な気道内分泌物が産生されたり粘液線毛系の活動性が減少したりして、粘液や塵埃のクリアランスが減少することになる[61]。粘液線毛装置によって移動する粘液は気管切開チューブの端に溜まり、2〜6時間以内にチューブをふさいでしまう。

図5-4。旧式の金属気管切開チューブ。内側のカニューレを抜き出した。内側カニューレを間欠的に抜去することにより、粘液をチューブの端からふき取ることが可能となり、チューブ閉塞症が予防できる。
気管切開チューブを挿管した患者の術後管理は、適切な水和を確保するために経静脈輸液、および気管切開チューブから使い捨ての加湿機(人口鼻など)を用いたり、気管瘻孔形成部位からネブライゼーションを行ったりすべきである[62]。加湿は100%飽和水蒸気で提供するべきである。間欠的な水のネブライゼーションは気道分泌を湿らせるためによく行われる。ウサギで換気とネブライゼーションを6時間続けた実験では、動脈壁肥厚、間質性および肺胞性肺水腫などの肺の変化を引き起こし、ネブライゼーションの行い過ぎという懸念を投げかけた[63]。気管切開チューブの先端に蓄積する粘液は、2〜6時間ごとにダブルルーメン・チューブの内側のカニューレを抜き清潔にすることにより除去される。緊急気管切開術が行なわれ、ダブルルーメン気管切開チューブが入手不能な場合、必要に応じ気管切開チューブを4〜6時間毎程度に抜き、新しいチューブと取り替えられるべきである。交換は、気管切開術で尾側の気管輪に設置されられた牽引糸を引き上げることにより容易になる。
できれば、気管の吸引は避ける。なぜなら、カテーテルの通過[64]および吸引陰圧[65]の両方が、気管気管支の外傷を引き起こす場合があるからである。吸引のその他の合併症には重度な低酸素がある。それは犬にカテーテル挿入してから15分程度続くことがある[66]。その他、吸引の重要な合併症に不整脈[67]および気胸[68]が報告されている。吸引が必要であると考えられる場合、動物はあらかじめ酸素で処理し、気管径の半分未満の軟性カテーテルを使用し、また、理想的には真空圧力を70〜100mmのHgで調節して行うべきである[69]。
一旦上気道閉塞がうまく治療され、腫脹が回復したならば、気管切開チューブの端を覆って、気道開存性をテストすることができる。チューブが気管の直径の75%未満なら、動物はチューブのまわりで快適に呼吸することができるに違いない。たまに、チューブの外部と気管の粘膜の間に粘液蓄積していると、チューブを閉塞した場合、呼吸できなくなることがある。上気道閉塞が解決されたことを他の臨床の徴候が示唆する場合、気管切開チューブのテスト除去が示されるかもしれない。チューブが抜かれれば、気管瘻孔形成部位はそのままで開放創として治癒する。皮膚を創傷清拭して閉じてはいけない。なぜなら、呼気時に気管瘻孔形成部位から空気が漏出し重度な皮下気腫を引き起こすからである。
著者は、Dr. R.O. Daviesの助言およびMs. Sharon Wardの支援に感謝する。
引用文献
1. Ohnishi T, Ogura JH: Partitioning of pulmonary resistance in the dog, Laryngoscope 79:1847, 1969.
2. Grandage J, Richardson K: Functional anatomy. In Slatter DH, editor: Textbook of small animal surgery, ed 2, vol I. Philadelphia, 1993, WB Saunders.
3. Guyton AC, Hall JE: Textbook of medical physiology, ed 9, Philadelphia, 1996, WB Saunders.
4. Milic-Emili J, Zin WA: Breathing responses to imposed mechanical loads. In Fishman AP, section editor; Cherniack AP, Widdicombe JG, volume editors: Handbook of physiology, the respiratory system, vol 2, ed 2, Baltimore, 1986, Williams and Wilkins.
5. Younes M: Mechanisms of respiratory load compensation. In Dempsey JA, Pack Al, editors: Regulation o f breathing, ed 2, New York, 1995, Marcel Dekker Inc.
6. Rochester DF, Truwit JD: Respiratory muscle failure in critical illness. In Shoemaker WC, editor: Textbook of critical care, ed 3, Philadelphia, 1995, WB Saunders.
7. Love S, Waterman AE, Lane JG: The assessment of corrective surgery for canine laryngeal paralysis by blood gas analysis: A review of 35 cases, J Small Anim Pract 28:597, 1987.
8. Harvey CE: Upper airway obstruction surgery I: Stenotic nares surgery in brachycephalic dogs, J Am Anim Hosp Assoc 18:535,1982.
9. Harvey CE: Upper airway obstruction surgery II: Soft palate resection in brachycephalic dogs, J Am Anim Hosp Assoc 18:538, 1982.
10. Coyne BE, Fingland RB: Hypoplasia of the trachea in dogs: 103 cases (1974-1990), J Am Vet Med Assoc 201:768, 1992.
11. Petrof BJ et al: Pharyngeal myopathy of loaded upper airway in dogs with sleep apnea, J Appl Physiol 76:1746, 1994.
12. Hendricks JC, Petrof BJ, Panckeri K et al: Upper airway dilating muscle hyperactivity during non-rapid eye movement sleep in English bulldogs, Am Rev Resp Dis 148:185, 1993.
13. Schotland HM, Insko EK, Panckeri KA et al: Quantitative magnetic resonance imaging of upper airway musculature in an animal model of sleep apnea, J Appl Physiol 81:1339, 1996.
14. Harvey CE: Everted laryngeal saccule surgery in brachycephalic dogs, J Am Anim Hosp Assoc 18:545, 1982.
15. Leonard HC: Collapse of the larynx and adjacent structures in the dog, .J Am Vet Med Assoc 137:360, 1960.
16. Harvey CE: Upper airway obstruction surgery IV: Partial laryngectomy in brachycephalic dogs, J Am Anim Hosp Assoc 18:548, 1982.
17. Kerr L: Pulmonary edema secondary to upper airway obstruction in dogs: A review of nine cases, J Am Anim Hosp Assoc 25:207, 1989.
18. Lee KWT, Downes JJ: Pulmonary edema secondary to laryngospasm in children, Anesthesiology 59:349, 1983.
19. Kamal RS, Agha S: Acute pulmonary oedema: A complication of upper airway obstruction, Anesthesia 39:464, 1984.
20. Weissman C, Damask MC, Yang J: Noncardiogenic pulmonary edema following laryngeal obstruction, Anesthesiology 60:163,1984.
21. Schwartz DR, Maroo A, Malhotra A et al: Negative pressure pulmonary hemorrhage, Chest 115:1194, 1999.
22. Mathieu-Costello 0, Willford DC, Fu Z et al: Pulmonary capillaries are more resistant to stress failure in dogs than in rabbits, J Appl Physiol 79:908, 1995.
23. Burnie AG, Simpson JW, Corcoran BM: Gastro-esophageal reflux and hiatus hernia associated with laryngeal paralysis in a dog, J Small Anim Pract 30:414, 1989.
24. Prymak C, Saunders HM, Washabau RJ: Hiatal hernia repair by restoration and stabilization of normal anatomy: An evaluation in four dogs and one cat, Vet Surg 18:386, 1989.
25. Baue AE, Hoffer RE: The effects of experimental hiatal hernia and histamine stimulation on the intrinsic esophageal sphincter, Surg Gynecol Obstet 125:791, 1967.
26. Henderson RD, Mugahe F, Jeejeebhoy KN et al: The motor defects of esophagitis, Can J Surg 17:112, 1974.
27. Ross JT, Matthiesen DT, Noone K et al: Complications and longterm results after partial laryngectomy for the treatment of idiopathic laryngeal paralysis in 45 dogs, Vet Surg 20:169, 1991.
28. Holt DE, Harvey CE: Idiopathic laryngeal paralysis: Results of treatment by bilateral vocal fold resection in 40 dogs, J Am Anim Hosp Assoc 30:389, 1994.
29. Trout NJ, Harpster NK, Berg J et al: Long-term results of unilateral ventriculocordectomy and partial arytenoidectomy for the treatment of laryngeal paralysis in 60 dogs, J Am Anim Hosp Assoc 30:401, 1994.
30. Mier A, Laroche C, Agnew JE et al: Tracheobronchial clearance in patients with bilateral diaphragmatic weakness, Am Rev Resp Dis 142:545, 1990.
31. Schmidt-Nowara WW, Altman AR: Atelectasis and neuromuscular respiratory failure, Chest 85:792, 1984.
32. Van Pelt DR, McKiernan BC: Pathogenesis and treatment of canine rhinitis, Vet Clin North Am Small Anim Pract 24:789, 1994.
33. Van Pelt DR, Lappin MR: Pathogenesis and treatment of feline rhinitis. Vet Clin North Am Small Anim Pract 24:807, 1994.
34. Coolman BR, Marretta SM, McKiernan BC et al: Choanal atresia and secondary nasopharyngeal stenosis in a dog, J Am Anim Hosp Assoc 34:497, 1998.
35. Wells MJ, Coyne JA, Prince JL: What is your diagnosis? J Am Vet Med Assoc 180:83, 1982.
36. Mitten RW: Nasopharyngeal stenosis in four cats, J Small Anim Pract 29:341, 1988.
37. Novo RE, Kramek B: Surgical repair of nasopharyngeal stenosis in a cat using a stent, J Am Anim Hosp Assoc 35:251, 1999.
38. Griffon DJ, Tasker S: Use of a mucosal advancement flap for the treatment of nasopharyngeal stenosis in a cat, J Small Anim Pract 41:71, 2000.
39. White RAS, Lane JG: Pharyngeal stick penetration injuries in the dog, J Small Anim Pract 29:13, 1988.
41. Kapatkin AS, Matthiesen DT, Noone KE et al: Results of surgery and long-term follow-up in 31 cats with nasopharyngeal polyps, 1 Am Anim Hosp Assoc 26:387, 1990.
42. Riley P: Nasopharyngeal grass foreign body in eight cats, J Am Vet Med Assoc 202:299, 1993.
43. Withrow SJ: Tumors of the gastrointestinal system: A, Cancer of the oral cavity. In Withrow SJ, MacEwan EG, editors: Small animal clinical oncology, ed 2, Philadelphia, 1996, WB Saunders.
44. Venker-van Haagen AJ, Engelse EJJ, van den Ingh TSGAM: Congenital subglottic stenosis in a dog. J Am Anim Hosp Assoc 17:223, 1981.
45. Peterson J, Streeter V: Laryngeal obstruction secondary to brodifacoum toxicosis in a dog, J Am Vet Med Assoc 208:352, 1996.
46. Saik JE, Toll SL, Diters RW et al: Canine and feline laryngeal neoplasia: A 10-year survey, J Am Anim Hosp Assoc 22:359, 1986.
47. Ogilvie GK: Tumors of the endocrine system. In Withrow SJ, MacEwan EG, editors: Small animal clinical oncology, ed 2, Philadelphia, 1996, WB Saunders.
48. Hardie EM, Spodnick GJ, Wison SD et al: Tracheal rupture in cats: 16 cases, J Am Vet Med Assoc 214:508, 1999.
49. Mitchell SL, McCarthy R, Rudloff E et al: Tracheal rupture associated with intubation in cats: 20 cases (1996-1998),J Am Vet Med Assoc 216:1592, 2000.
50. Lotti U, Niebauer GW: Tracheobronchial foreign bodies of plant origin in 153 hunting dogs, Comp Cont Ed Pract Vet 14:7, 1992.
51. Carlisle CH, Biery DN, Thrall DE: Tracheal and laryngeal tumors of the dog and cat: Literature review and 13 additional patients, Vet Radiol 32:229, 1991.
52. Brovida C, Castagnaro M: Tracheal obstruction due to an eosinophilic granuloma in a dog: Surgical treatment and clinicopathological observations, J Am Anim Hosp Assoc 28:8, 1992.
53. Metcalfe SS: Filaroides osleri in a dog, Aust Vet Pract 27:65, 1997.
54. Cobb MA, Fischer MA: Crenosoma vulpis infection in a dog, Vet Rec 130:452, 1992.
55. Blocker TL, Roberts BK: Acute tracheal obstruction associated with anticoagulant rodenticide intoxication in a dog, J Small Anim Pract 40:577, 1999.
56. Sheaffer KA, Dillon AR: Obstructive tracheal mass due to an inflammatory polyp in a cat, J Am Anim Hosp Assoc 32:431, 1996.
57. Fitzgerald SD, Johnson CA, Peck EJ: A fatal case of intrathoracic cuterebriasis in a cat, J Am Anim Hosp Assoc 32:353, 1996.
58. Harvey CE, Goldschmidt MH: Healing following short duration transverse incision tracheotomy in the dog, Vet Surg 11:77, 1982.
59. Smith MM, Saunders GK, Leib MS et al: Evaluation of horizontal and vertical tracheotomy healing following short duration tracheostomy in dogs, Vet Surg 23:416, 1994.
60. Macintire DK, Henderson RA, Wilson ER et al: Transverse flap tracheostomy: A technique for temporary tracheostomy of intermediate duration, J Vet Emerg Crit Care 5:25, 1995.
61. Tsuda T, Noguchi H, Takumi Y et al: Optimum humidification of air administered to a tracheostomy in dogs: Scanning electron microscopy and surfactant studies, J Anaesth 49:965, 1977.
62. Mebius C: A comparative evaluation of disposable humidifiers, Acta Anaesthesiol Scand 27:403, 1983.
63. John E, Ermocilla R, Golden J et al: Effects of gas temperature and particulate water on rabbit lungs during ventilation, Pediatr Res 14: 1186, 1980.
64. Sackner MA, Lander J, Greenletch N et al: Pathogenesis and prevention of tracheobronchial damage with suction procedures, Chest 64:284, 1973.
65. Plum F, Dunning MF: Techniques for minimizing trauma to the tracheobronchial tree after tracheotomy, N Eng J Med 254:193, 1956.
66. Naigow D, Powaser MM: The effect of different endotracheal suction procedures on arterial blood gases in a controlled experimental model, Heart Lung 6:808, 1977.
67. Shim C, Fernandez R, Fine N et al: Cardiac arrhythmias resulting from tracheal suctioning, Am International Med 71:1149, 1969.
68. Vaughan RS, Menke JA, Giacoia GP: Pneumothorax: A complication of endotracheal tube suctioning, J Pediatr 92:633, 1978.
69. Young CS: Recommended guidelines for